Titrage pH-métrique et conductimétrique
Les titrages pH-métriques sont parfaits pour les transformations acide-base. Tu mesures le pH après chaque ajout de solution titrante et tu obtiens une courbe pH = f(V) super révélatrice !
Pour trouver le volume équivalent (VE), tu as deux méthodes : la méthode des tangentes ou celle de la dérivée. L'important c'est de repérer le saut de pH qui indique ton point d'équivalence.
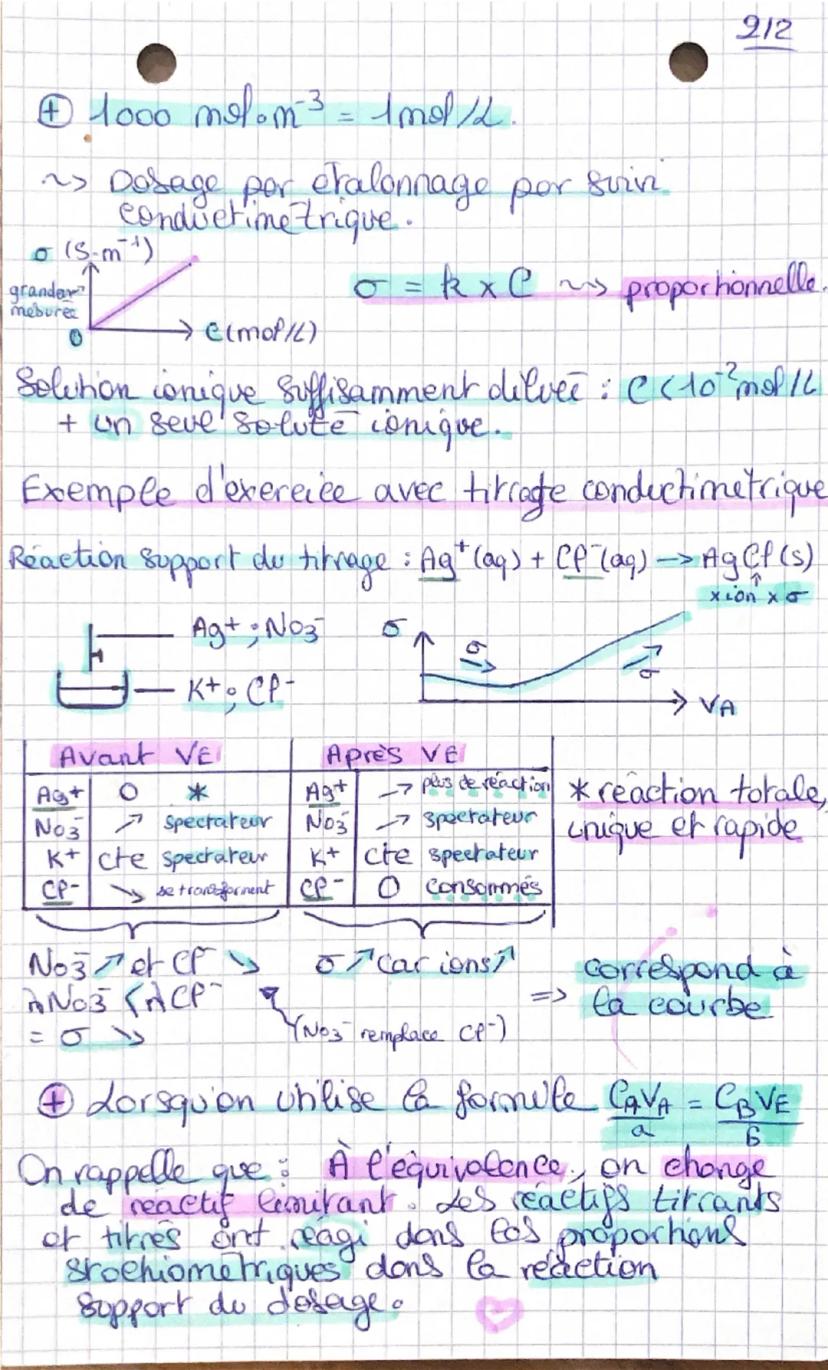
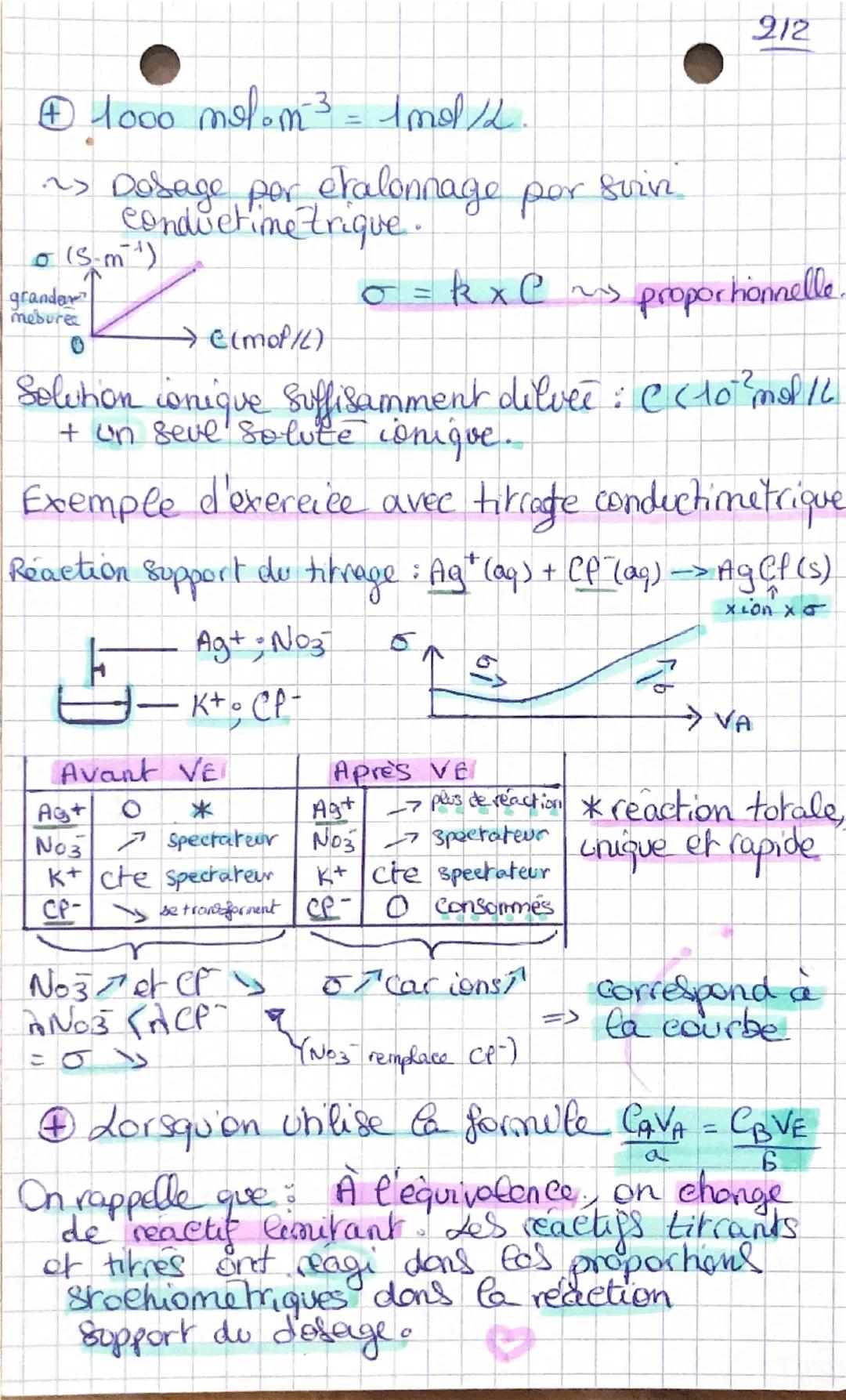
Le titrage conductimétrique utilise la loi de Kohlrausch : σ = Σλ ion × [ion]. La conductivité change pendant le titrage car les ions se transforment. Avant l'équivalence, certains ions disparaissent, après l'équivalence, d'autres ions s'accumulent.
Pour des solutions suffisamment diluées C<10−2mol/L, la conductivité est proportionnelle à la concentration : σ = k × C. Tu peux donc faire un étalonnage en traçant σ = f(C).
💡 Rappel essentiel : À l'équivalence, tes réactifs titrant et titré ont réagi dans les proportions stœchiométriques exactes !