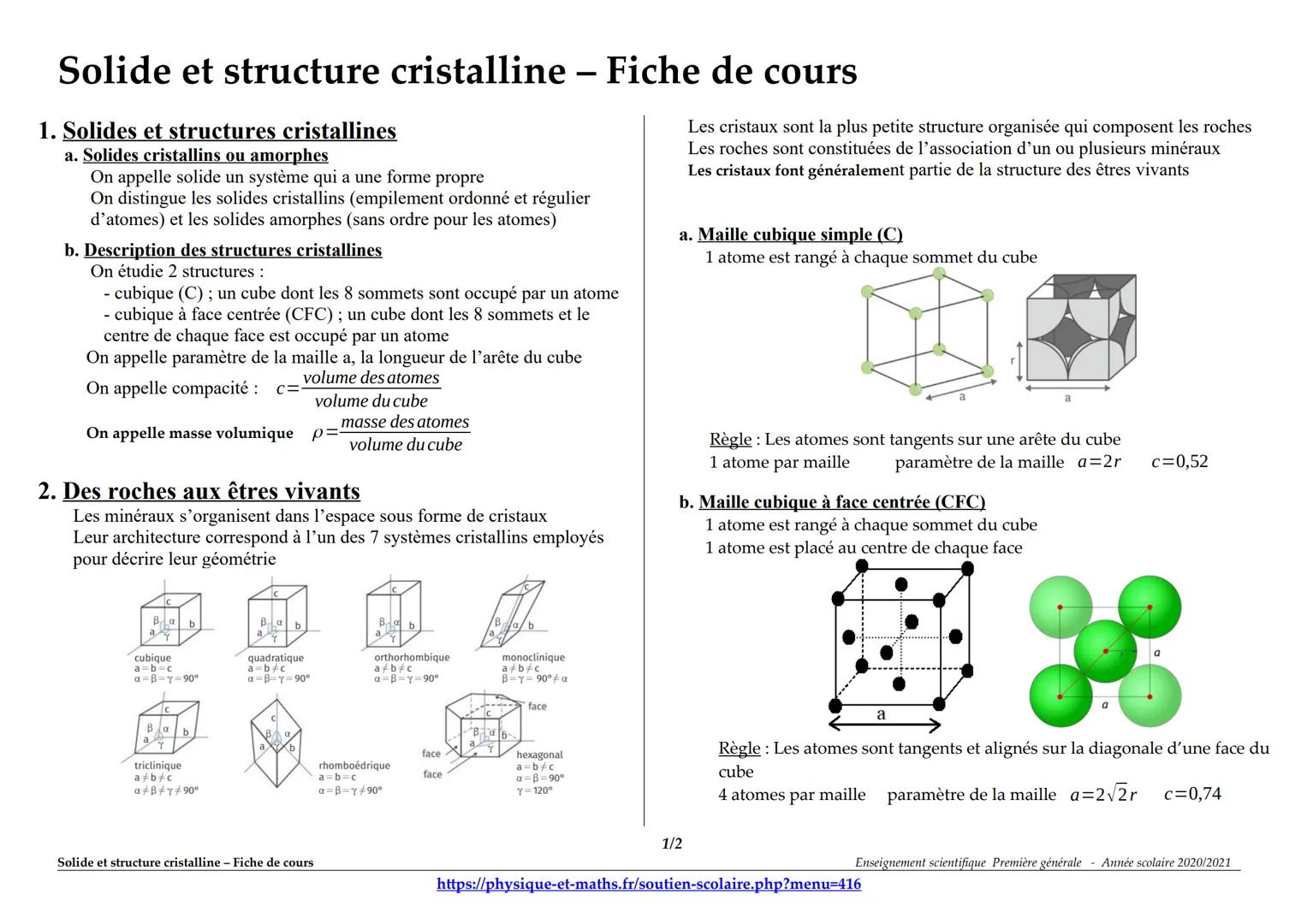
Solides et structures cristallines
Tu as sûrement remarqué que certains matériaux ont des formes géométriques parfaites, comme les cristaux de quartz. C'est parce que leurs atomes sont rangés de manière ordonnée et régulière : on appelle ça des solides cristallins. À l'inverse, le verre a des atomes disposés n'importe comment, c'est un solide amorphe.
Pour étudier ces structures, on utilise deux modèles principaux. La structure cubique simple (C) ressemble à un dé avec un atome à chaque sommet. La structure cubique à face centrée (CFC) ajoute un atome au centre de chaque face du cube.
Trois notions importantes à retenir : le paramètre de maille (longueur du côté du cube), la compacité (proportion d'espace occupée par les atomes) et la masse volumique. Ces valeurs permettent de calculer les propriétés du matériau !
Astuce : Pour visualiser ces structures, imagine des balles de ping-pong empilées de manière ordonnée - c'est exactement comme ça que les atomes s'organisent !
Dans la nature, on trouve 7 systèmes cristallins différents qui décrivent toutes les géométries possibles. Des minéraux s'assemblent pour former les roches, et même les êtres vivants utilisent des structures cristallines dans leur organisation.