Structure atomique et liaisons moléculaires
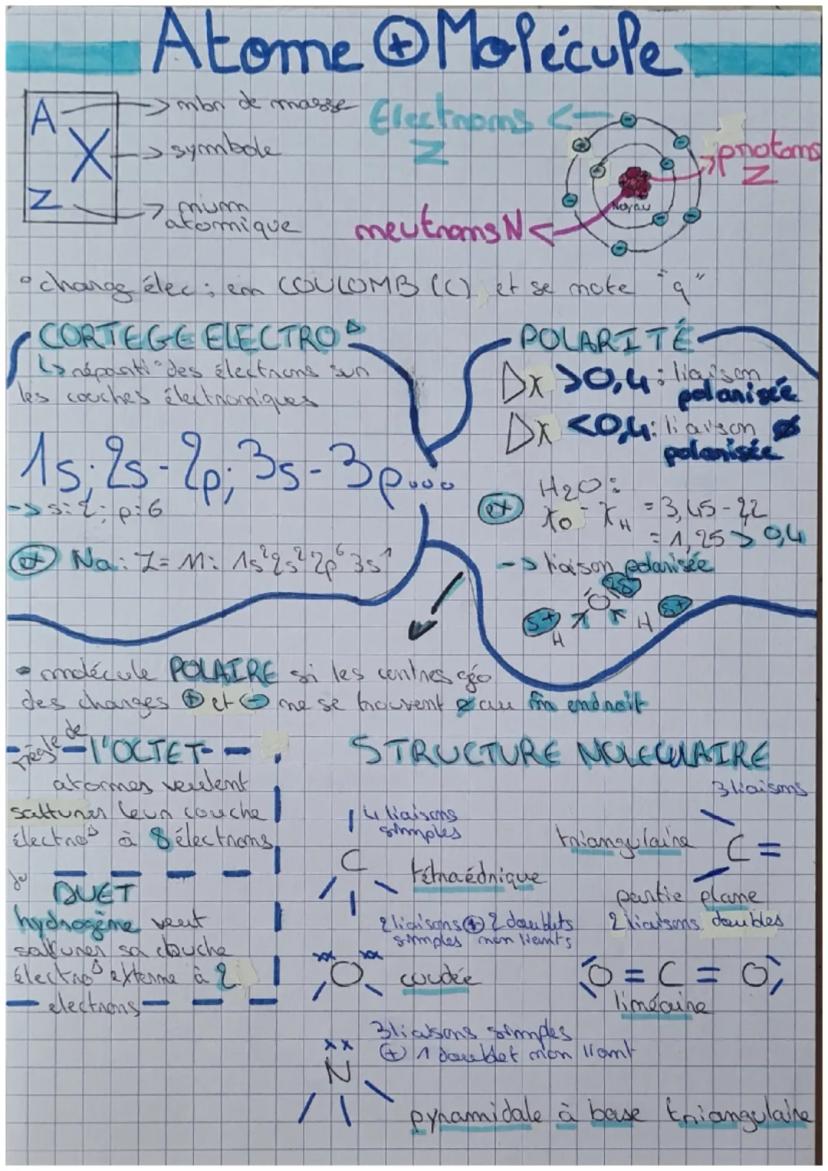
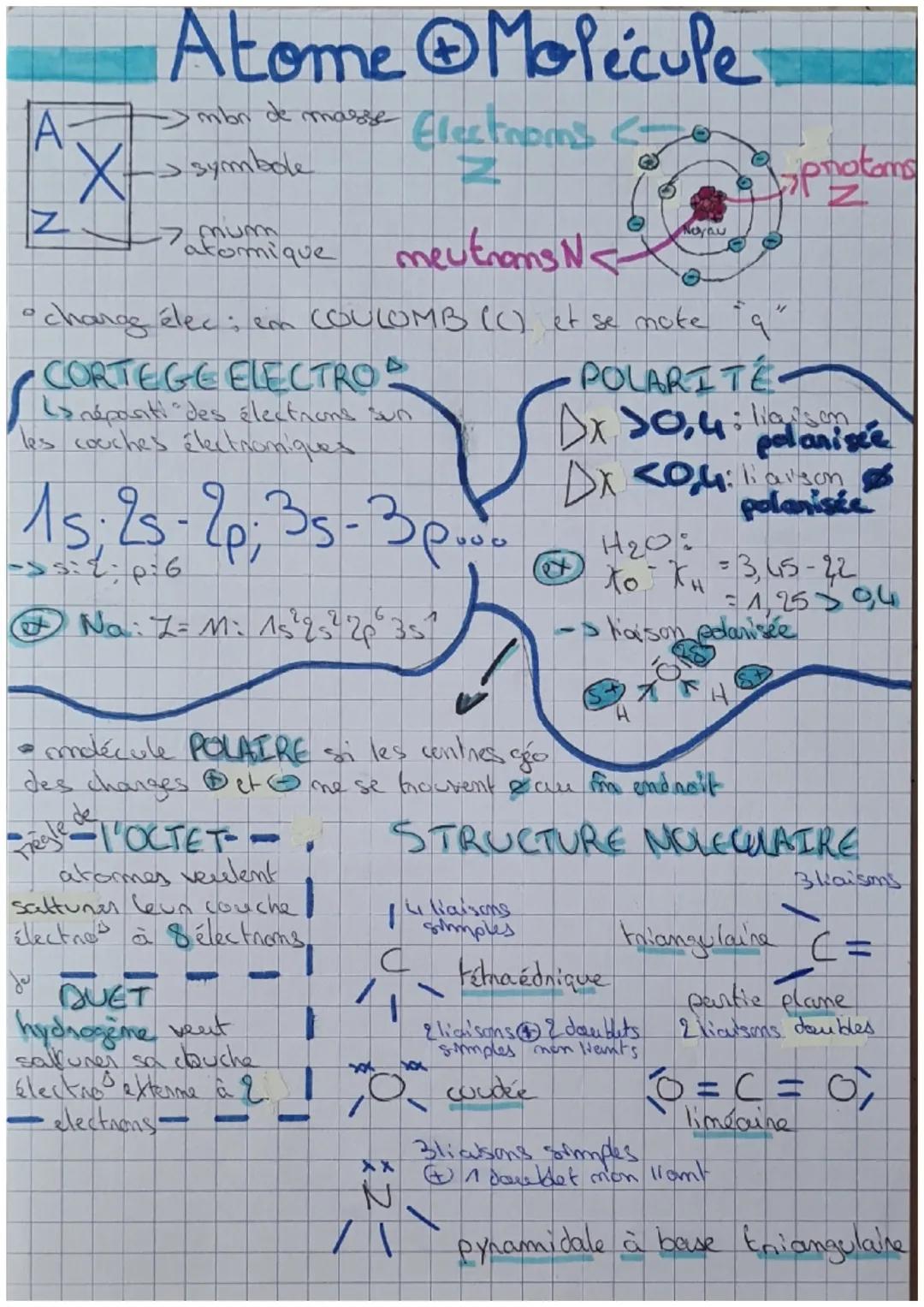
Chaque atome a une carte d'identité précise : son numéro atomique Z (nombre de protons), son symbole, et sa masse. Les électrons gravitent autour du noyau selon un plan bien organisé appelé cortège électronique.
Les électrons se placent dans des "boîtes" numérotées : 1s, 2s, 2p, 3s, 3p... C'est comme ranger tes vêtements dans des tiroirs spécifiques ! Par exemple, le sodium (Na) a cette configuration : 1s²2s²2p⁶3s¹.
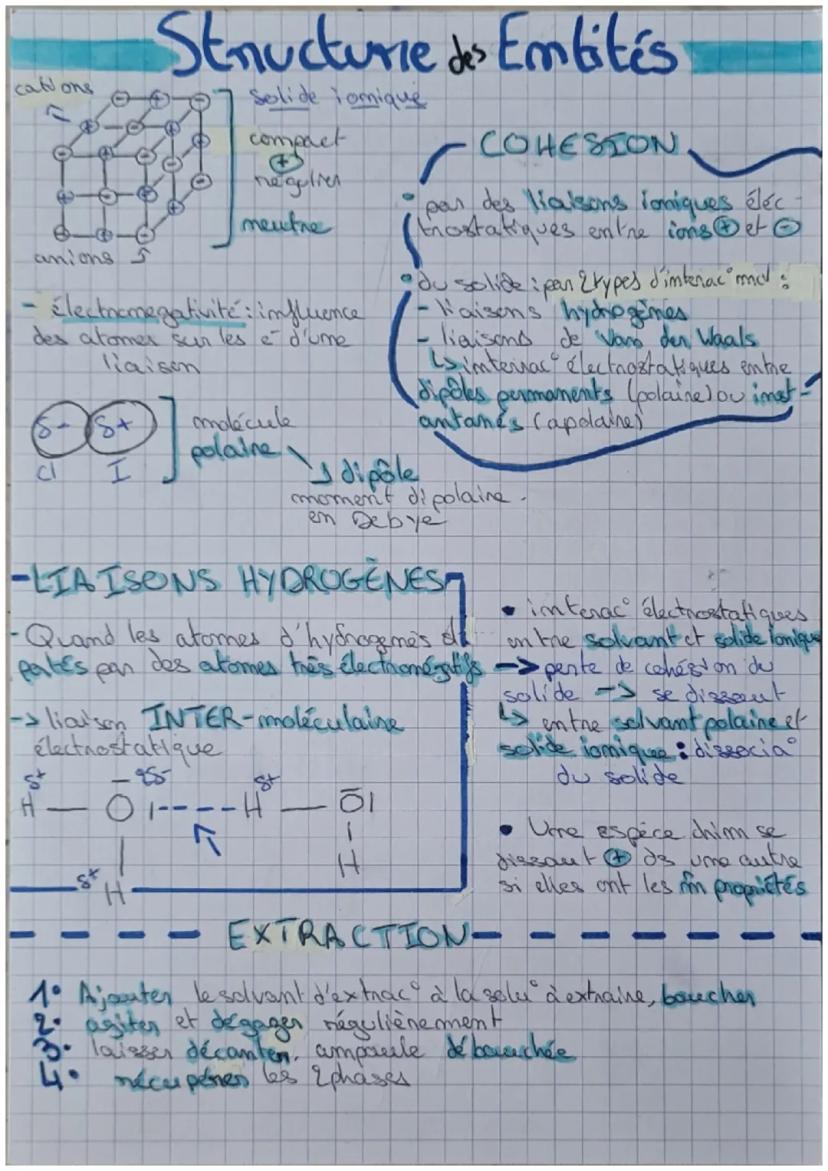
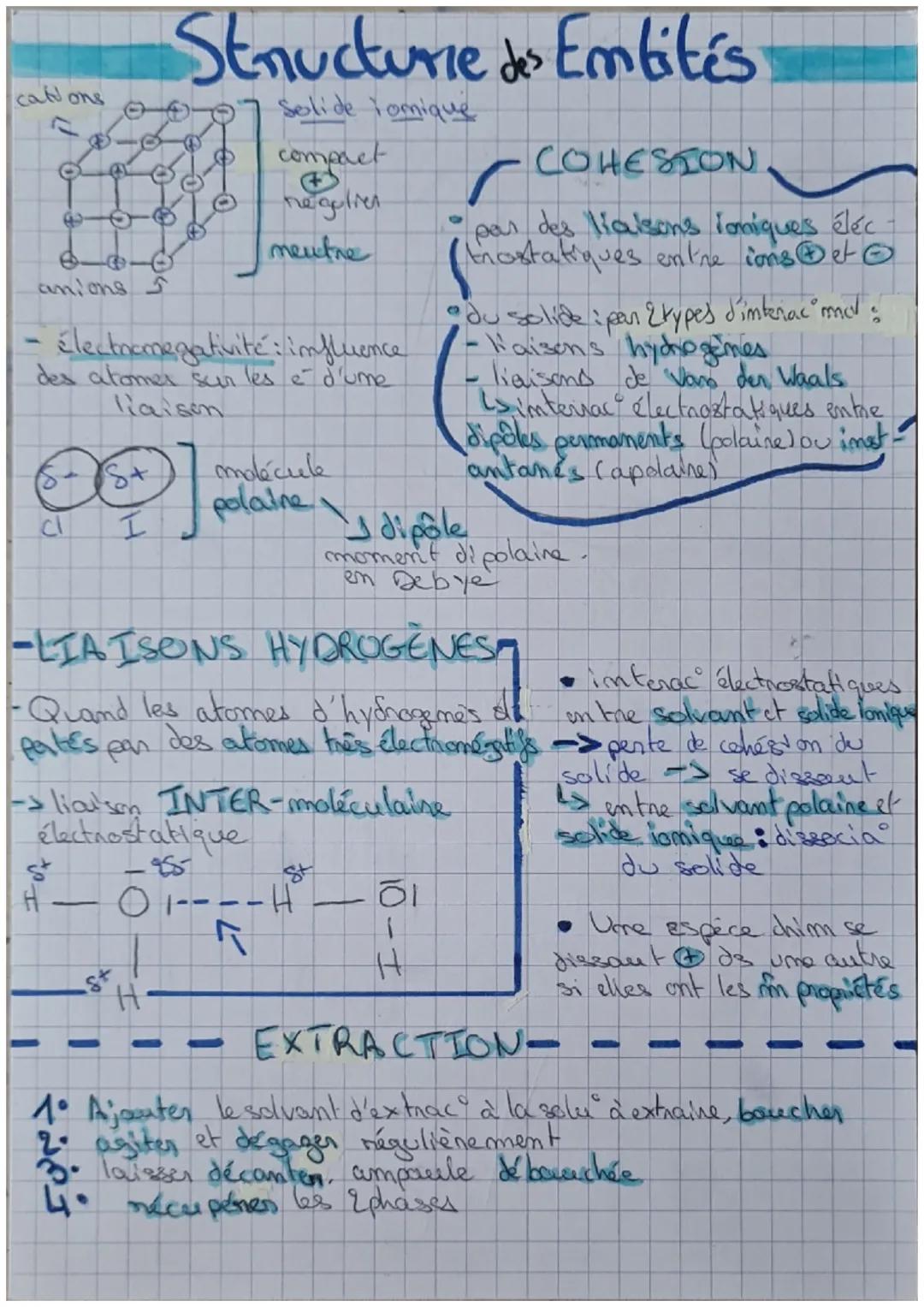
Pour savoir si une liaison est polarisée, tu calcules la différence d'électronégativité (Δχ). Si c'est supérieur à 0,4, la liaison est polarisée. Dans H₂O par exemple : χO - χH = 3,45 - 2,2 = 1,25 > 0,4, donc liaison polarisée !
Astuce : La règle de l'octet, c'est simple : chaque atome veut 8 électrons sur sa couche externe (sauf l'hydrogène qui n'en veut que 2).