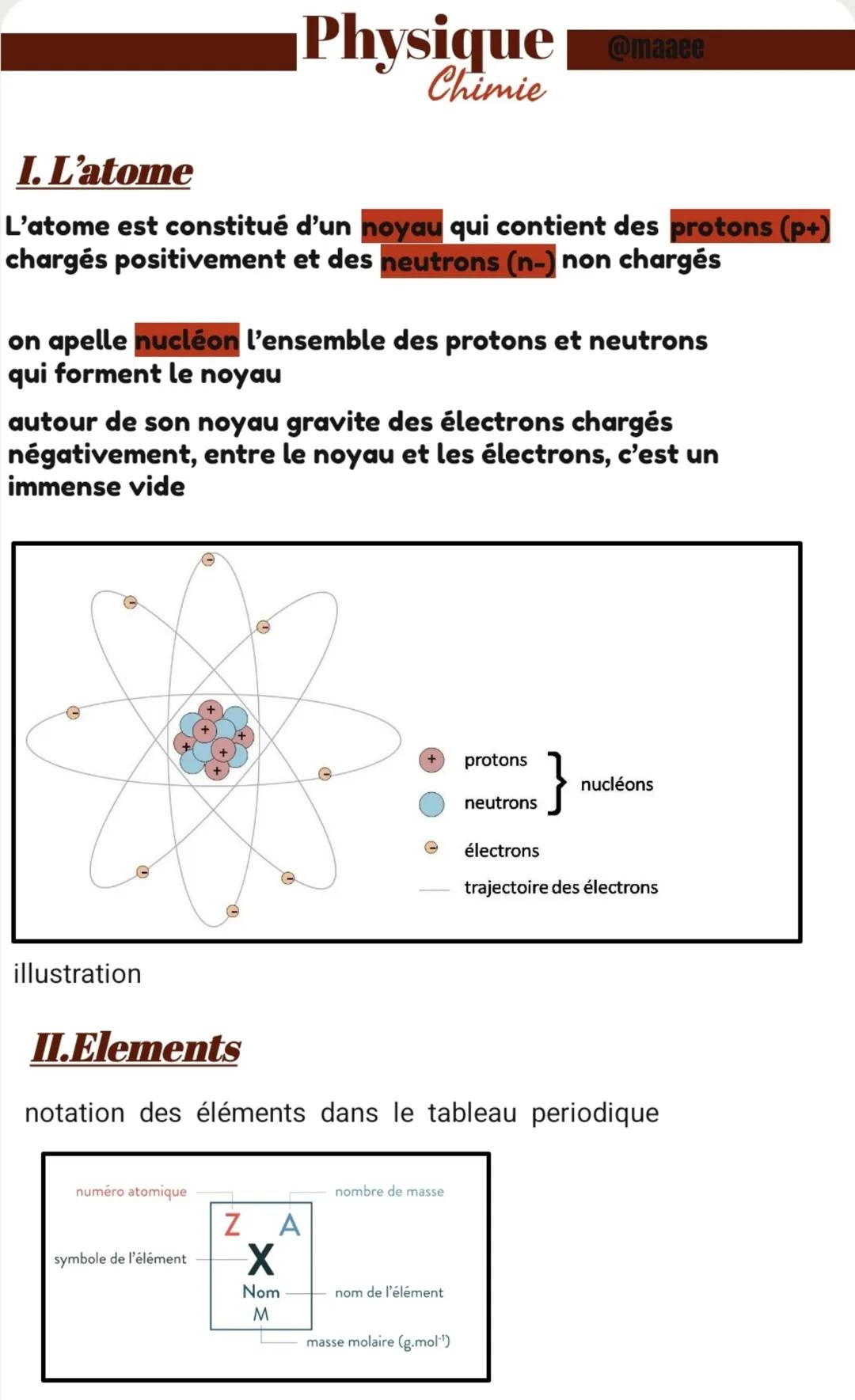
L'atome : un univers miniature
Imagine que tu puisses rétrécir jusqu'à voir l'intérieur d'un atome - tu découvrirais un monde étonnant ! L'atome ressemble un peu à un système solaire microscopique avec un centre dense et beaucoup d'espace vide autour.
Au cœur de l'atome se trouve le noyau, qui contient deux types de particules. Les protons portent une charge positive p+ tandis que les neutrons n'ont aucune charge électrique (ils sont neutres). Ensemble, protons et neutrons forment ce qu'on appelle les nucléons.
Autour de ce noyau gravitent les électrons, des particules chargées négativement qui tournent à une vitesse incroyable. Entre le noyau et les électrons, il y a principalement du vide - si un noyau avait la taille d'une balle de tennis, les électrons seraient à plusieurs kilomètres !
Le savais-tu ? Un atome est électriquement neutre car il contient autant de protons charges+ que d'électrons charges−.
Les éléments et leur carte d'identité
Chaque élément du tableau périodique possède sa propre "carte d'identité" avec des informations essentielles. Tu reconnaîtras facilement ces données car elles apparaissent dans chaque case du tableau.
Le numéro atomique Z indique le nombre de protons dans le noyau - c'est l'identité unique de chaque élément. Le nombre de masse A correspond au total des nucléons protons+neutrons. Le symbole X représente l'abréviation de l'élément, souvent basée sur son nom latin.
Tu trouveras aussi le nom complet de l'élément et sa masse molaire M exprimée en g.mol⁻¹. Cette dernière information te sera très utile pour tes calculs en chimie !
Astuce pratique : Pour retenir l'organisation, pense à "ZANS" - Z (numéro atomique), A (nombre de masse), N (nom), S (symbole).