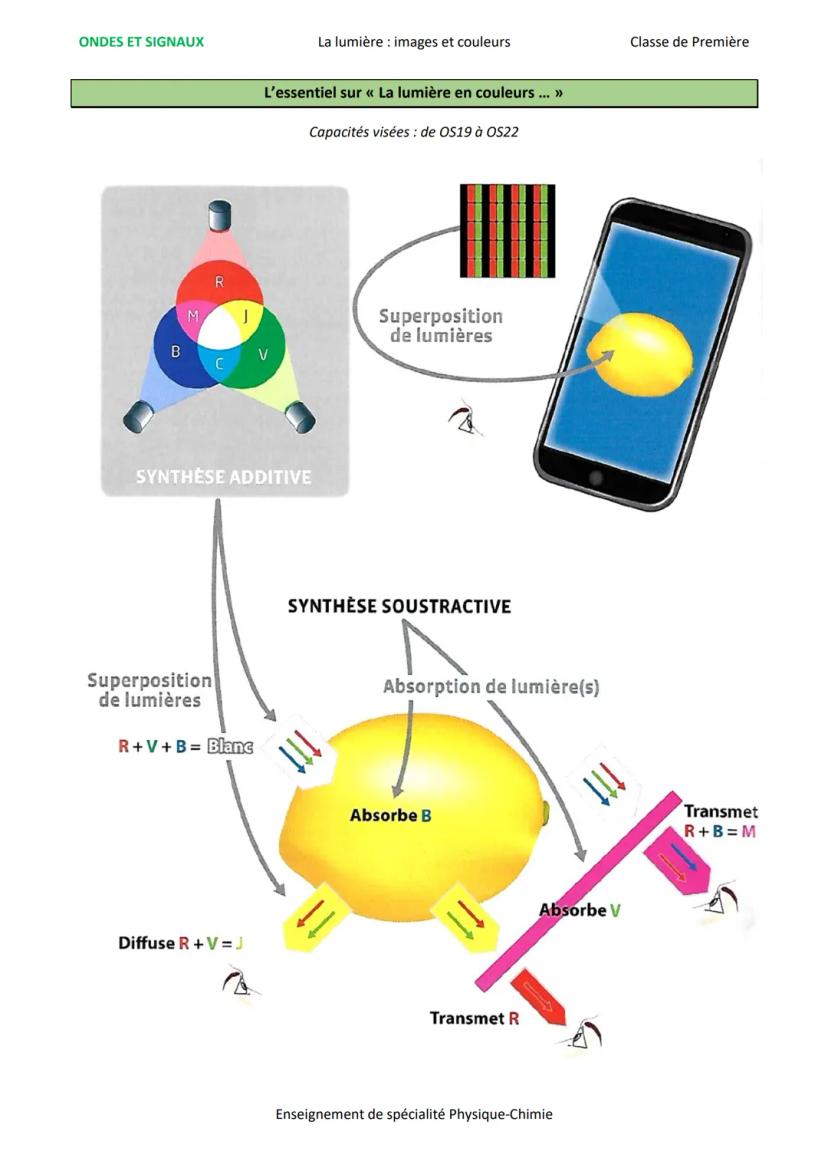
L'interaction lumière-matière et les spectres
Les atomes sont comme des "empreintes digitales" lumineuses ! Chaque élément chimique a son propre spectre unique, ce qui permet de l'identifier à distance.
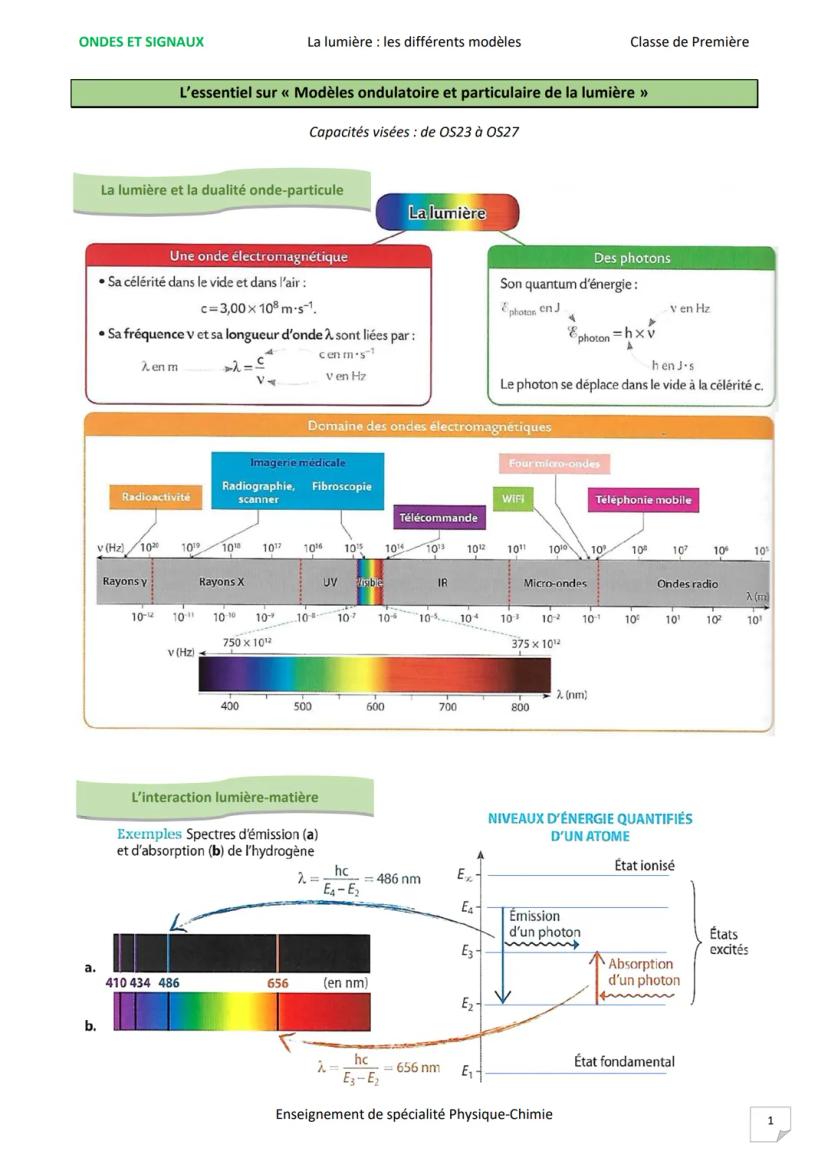
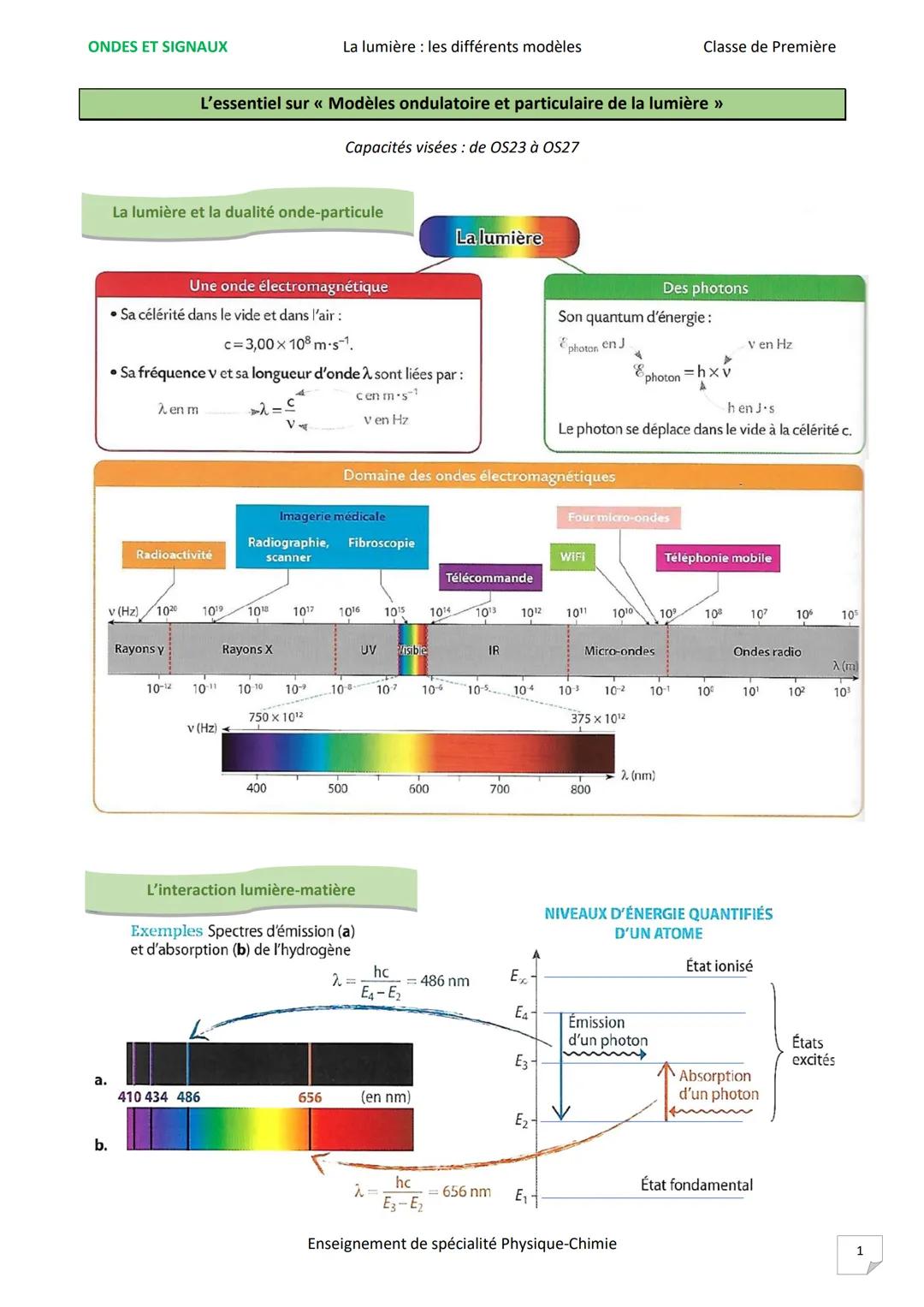
Les niveaux d'énergie quantifiés des atomes expliquent tout. Un électron peut absorber un photon et "monter" à un niveau d'énergie supérieur, puis redescendre en émettant un photon de même énergie.
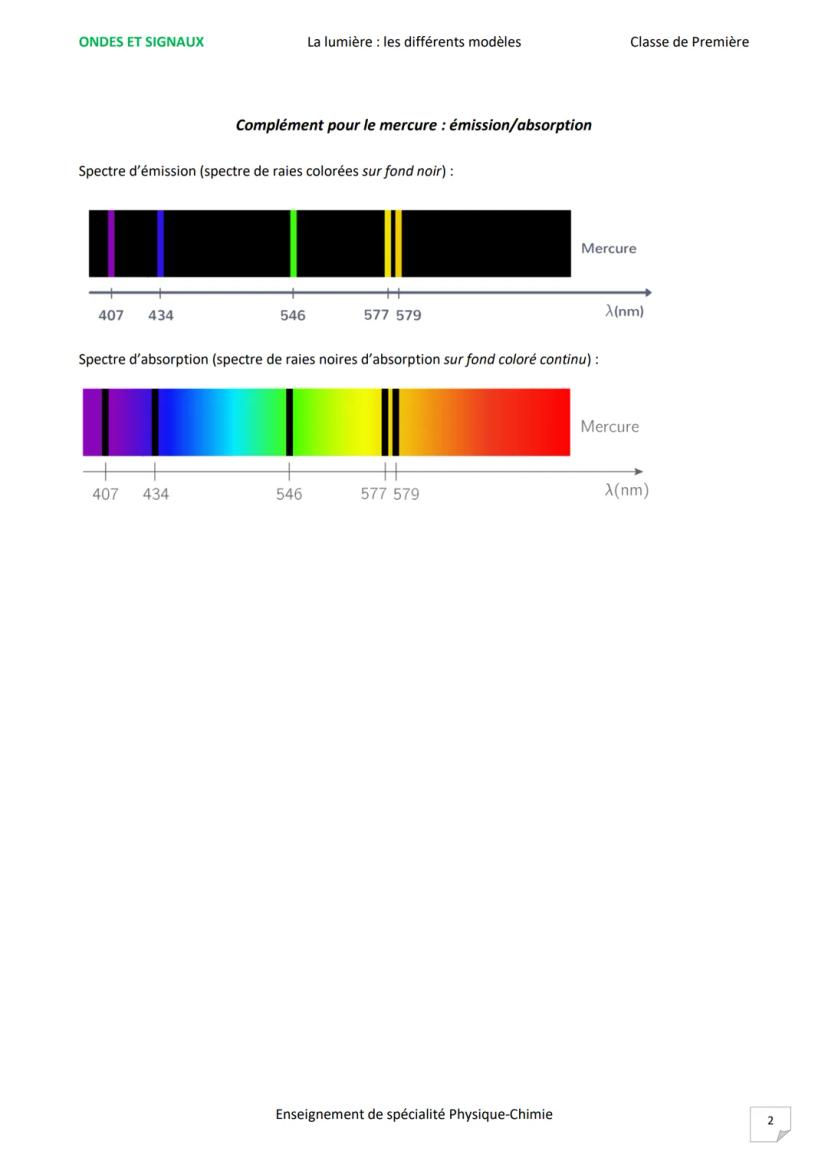
Le spectre d'émission montre des raies colorées sur fond noir : l'atome émet des photons à des longueurs d'onde précises. Le spectre d'absorption présente des raies noires sur fond coloré : l'atome absorbe exactement les mêmes longueurs d'onde.
L'exemple du mercure montre parfaitement cette symétrie : ses raies d'émission (407, 434, 546, 577, 579 nm) correspondent exactement à ses raies d'absorption !
Application concrète : Cette technique permet aux astronomes d'analyser la composition des étoiles à des millions de kilomètres !