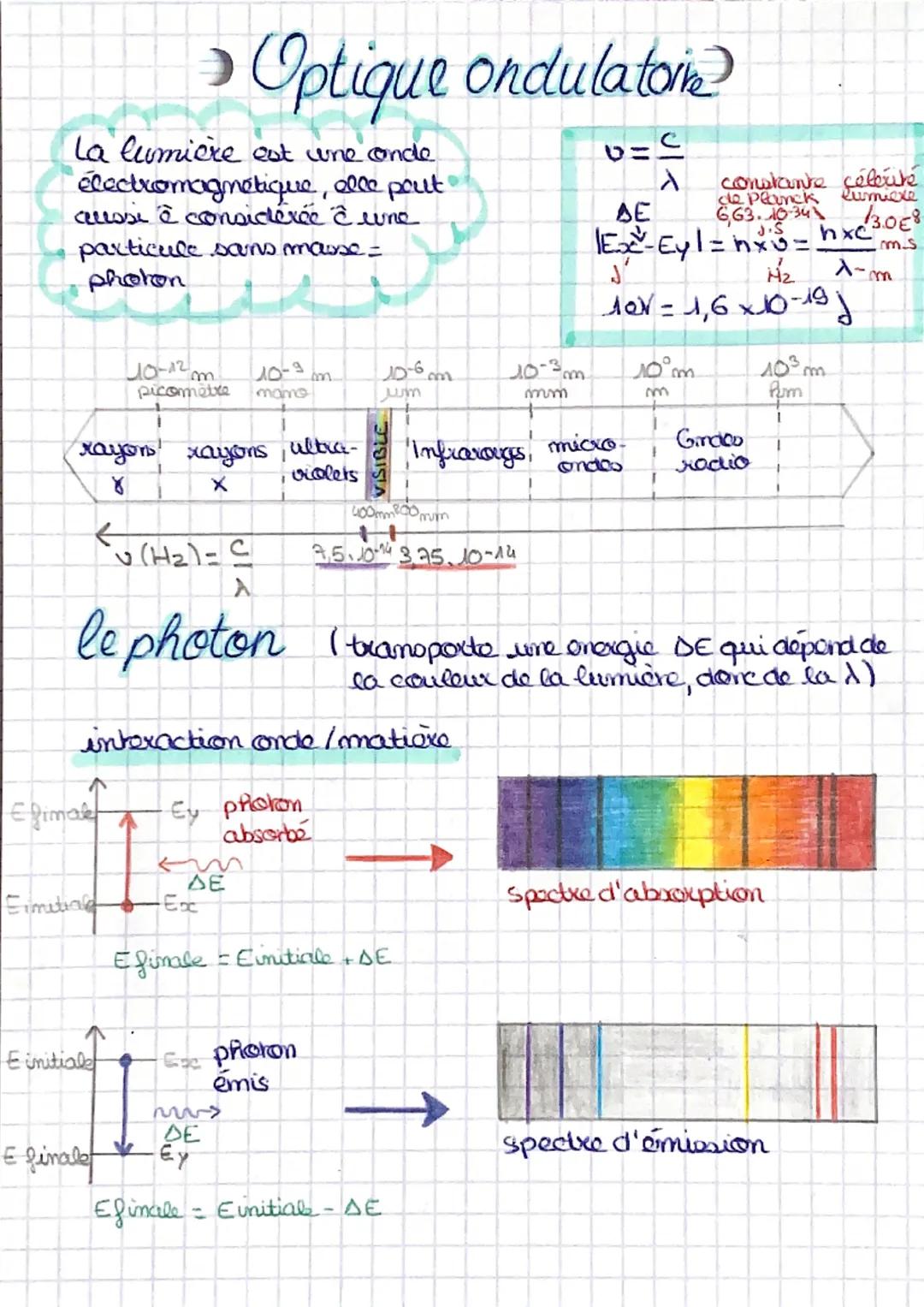
États d'énergie de l'atome d'hydrogène
L'atome d'hydrogène est comme un escalier énergétique avec des marches bien définies ! Chaque niveau d'énergie correspond à une position possible pour l'électron, depuis l'état stable E₀ −13,6eV jusqu'à l'ionisation E∞ (0 eV).
Quand un photon frappe l'atome, l'électron peut "monter les marches" vers un état excité (E₁, E₂, E₃...). Mais attention, il ne peut pas s'arrêter n'importe où - seulement sur les niveaux autorisés ! C'est ce qu'on appelle la quantification de l'énergie.
L'électron excité redescend rapidement vers l'état stable en émettant un photon. Cette émission crée le spectre d'émission, unique pour chaque élément. C'est comme ça qu'on identifie les éléments dans les étoiles !
💡 À retenir : Chaque atome a sa propre "carte d'identité" lumineuse grâce à ses niveaux d'énergie quantifiés.