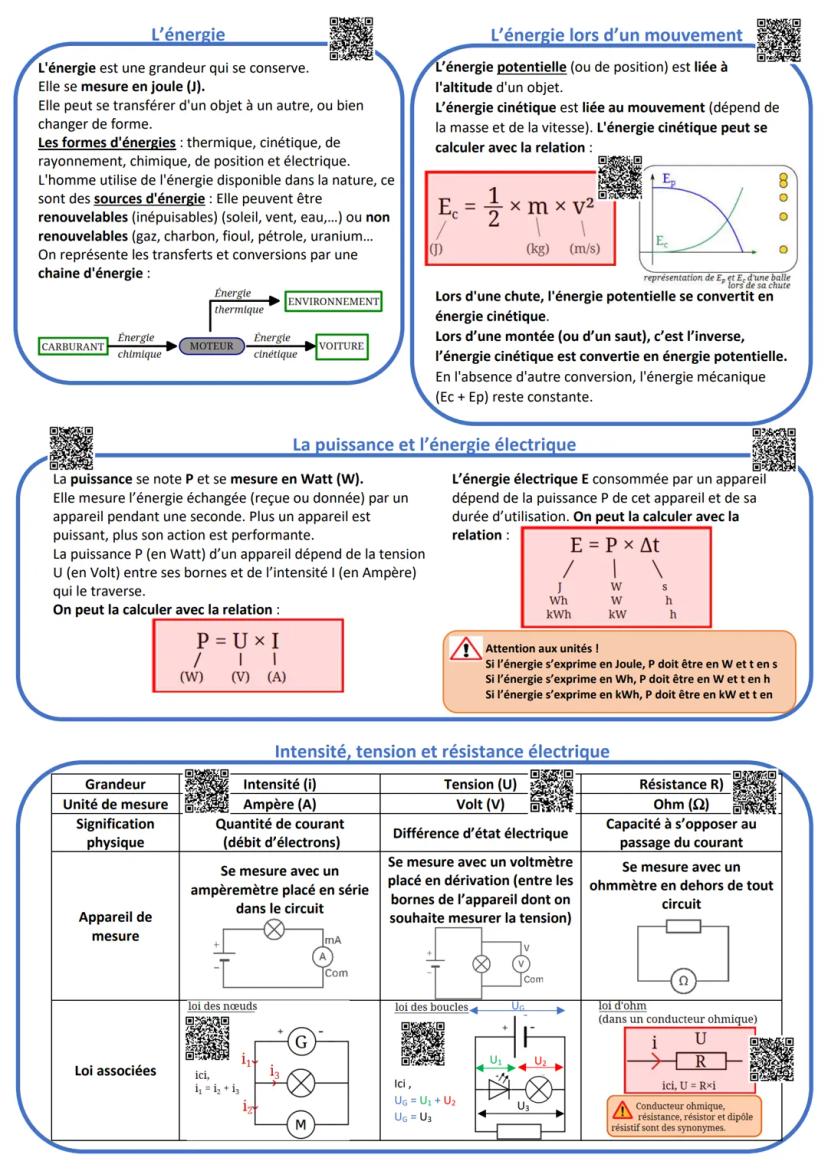
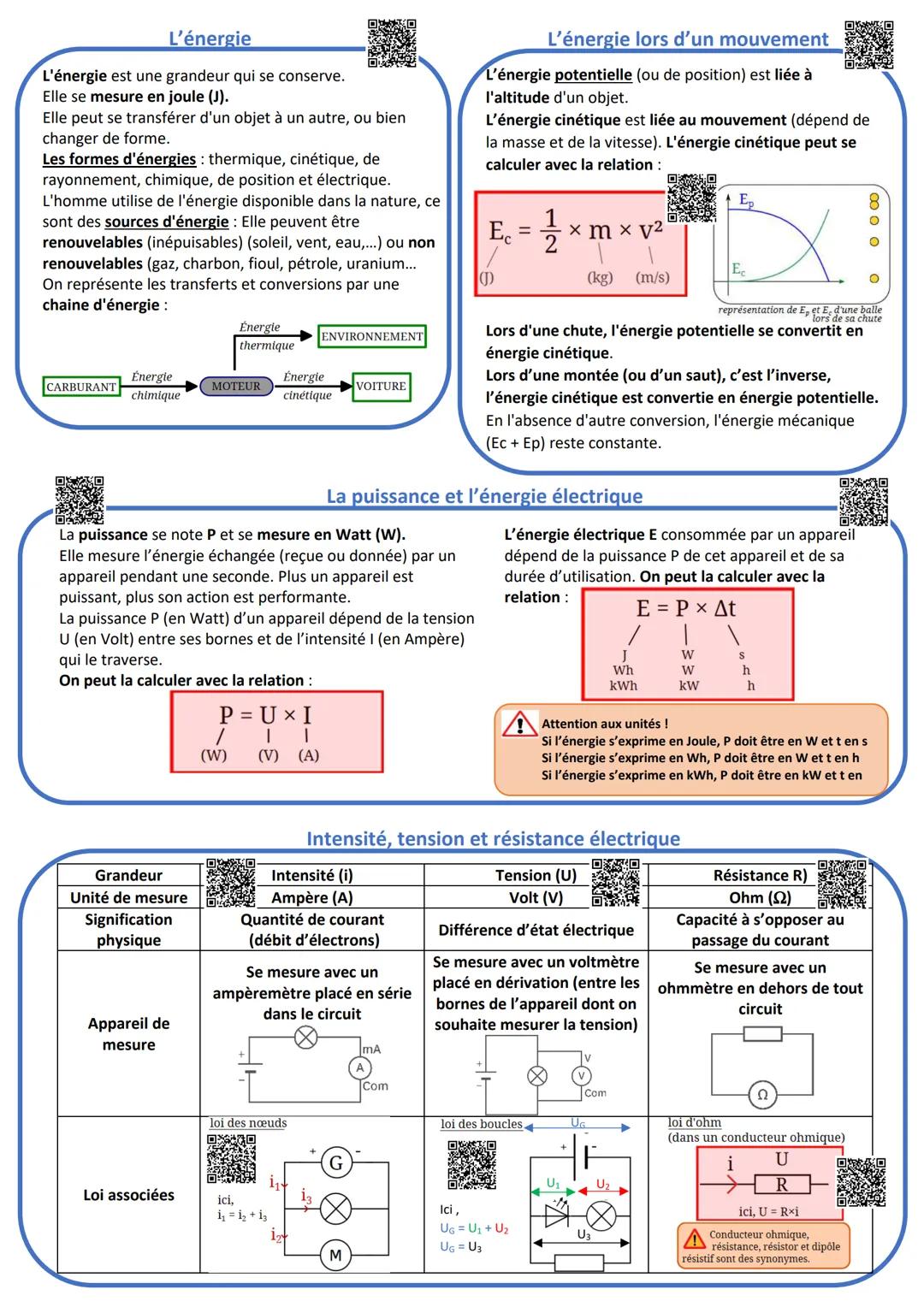
Le pH et les solutions
Le pH mesure l'acidité d'une solution sur une échelle de 0 à 14, sans unité. En dessous de 7 c'est acide (comme le citron), au-dessus c'est basique (comme la lessive), et 7 c'est neutre (comme l'eau pure).
L'acidité vient des ions H+, la basicité des ions HO-. Plus il y a d'ions H+, plus c'est acide ! Les solutions très acides ou très basiques sont corrosives - toujours porter lunettes et gants.
Quand tu mélanges un acide et une base, ils se neutralisent selon : H+ + HO- → H₂O. Le pH se rapproche alors de 7.
Attention : Ne jamais goûter une solution pour tester son pH !
États de la matière et masse volumique
La matière existe sous trois états : solide (molécules liées et ordonnées), liquide (liées mais désordonnées) et gazeux (dispersées et désordonnées). Pense à l'eau : glace, eau liquide, vapeur !
La masse volumique ρ (rhô) caractérise la densité d'un matériau avec ρ = m/V. Le béton a une masse volumique plus élevée que la mousse - c'est pourquoi il est plus lourd à volume égal. Cette propriété dépend du matériau, pas de la taille de l'objet.
Astuce unités : g/cm³, kg/L, g/mL... vérifie toujours la cohérence !
Molécules et transformations chimiques
Une molécule est un assemblage d'atomes. Tu dois connaître quelques molécules importantes : H₂O (eau), O₂ (dioxygène), CO₂ (dioxyde de carbone), CH₄ (méthane)...
Dans une transformation physique, les molécules restent identiques (exemple : faire fondre de la glace). Dans une transformation chimique, les molécules des réactifs se transforment en nouvelles molécules appelées produits.
Une équation chimique ressemble à : CH₄ + 2 O₂ → CO₂ + 2 H₂O. Les nombres indiquent les proportions, et les atomes sont toujours conservés des deux côtés !
L'air contient environ 80% de diazote (N₂) et 20% de dioxygène (O₂), plus quelques gaz à effet de serre.
Règle d'or : Dans une réaction chimique, rien ne se perd, rien ne se crée, tout se transforme !