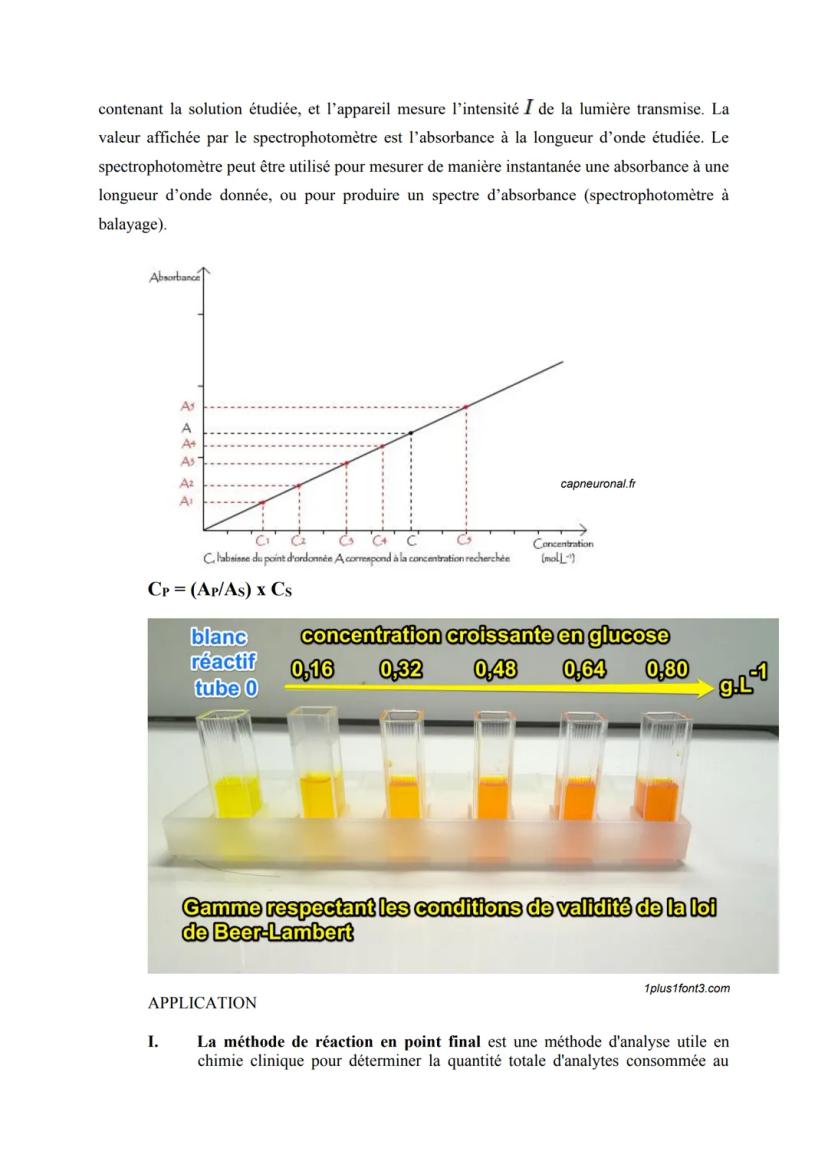
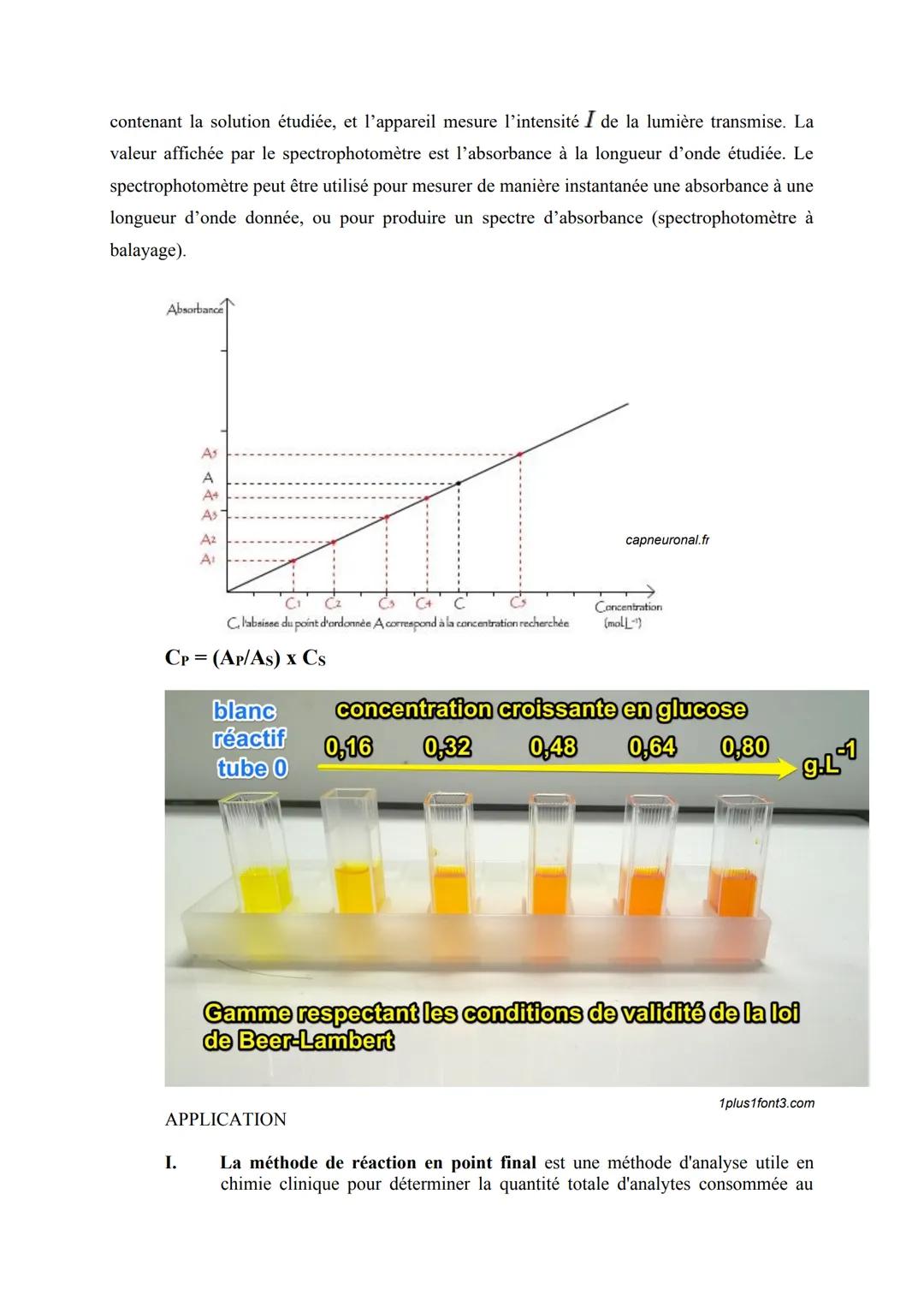
La spectrophotométrie et la loi de Beer-Lambert
Imagine que tu as une solution colorée devant toi. Plus elle est concentrée, plus elle absorbe la lumière - c'est le principe de base de la spectrophotométrie. Cette méthode quantitative te permet de connaître exactement la concentration d'une substance juste en mesurant son absorbance.
La loi de Beer-Lambert est ton équation magique : A = ε × C × l. Ici, A représente l'absorbance (sans unité), ε est le coefficient d'extinction molaire (en L.mol⁻¹.cm⁻¹), C la concentration molaire, et l l'épaisseur de ta cuvette en cm.
Cette loi fonctionne parce que l'absorption de lumière est proportionnelle à la concentration et au trajet optique. Plus ta solution est concentrée ou plus le trajet est long, plus elle absorbe !
💡 Astuce : Attention aux logarithmes ! On utilise log₁₀ pour les liquides et ln pour les gaz - vérifie toujours lequel a été utilisé.