Le tableau d'avancement : ton meilleur allié en chimie
Tu vas adorer cet outil qui simplifie énormément les calculs de réactions ! Le tableau d'avancement organise toutes les informations d'une réaction chimique de manière claire et méthodique.
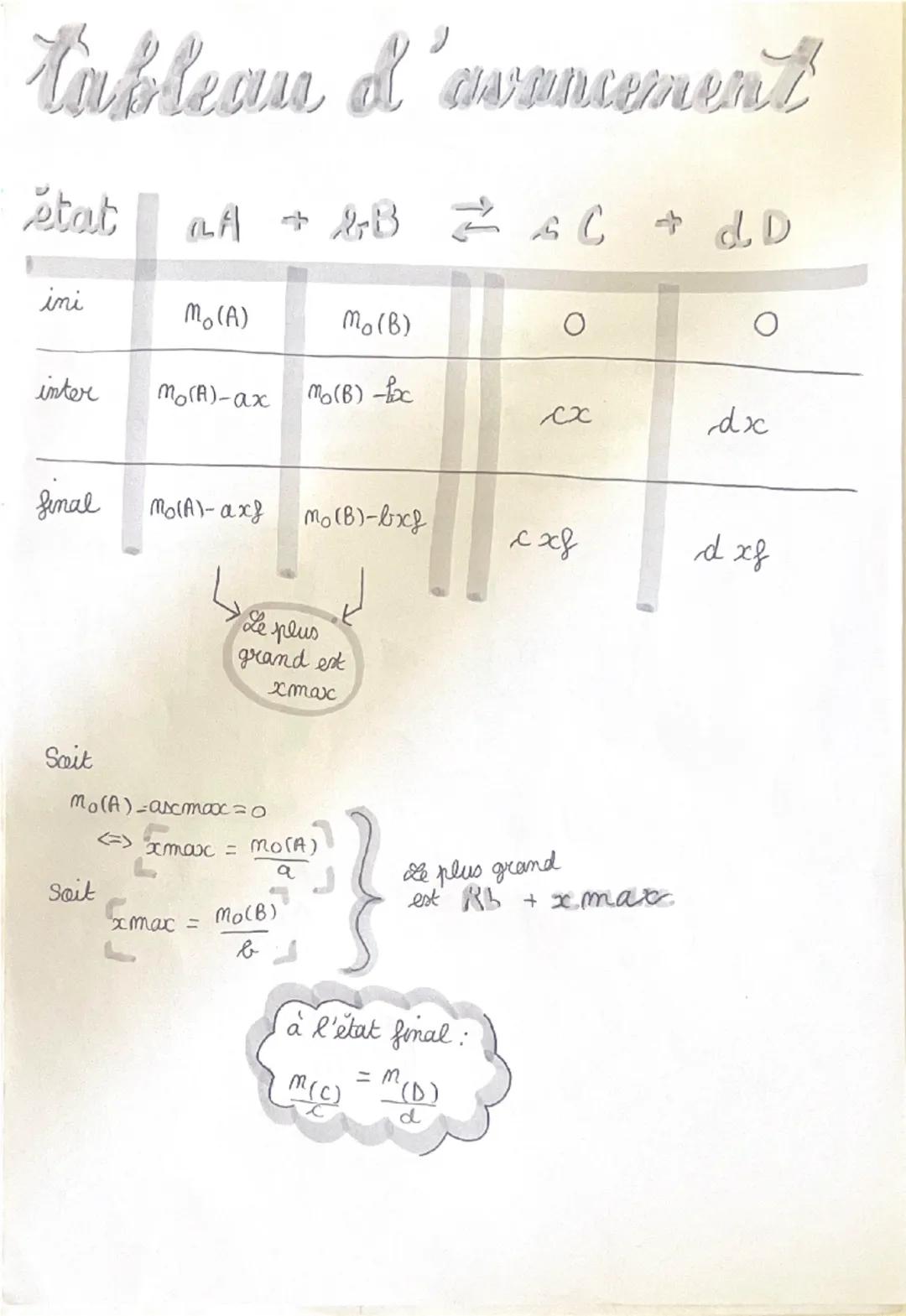
Pour une réaction générale aA + bB → cC + dD, tu construis un tableau avec trois états : initial, intermédiaire et final. À l'état initial, tu notes les quantités de matière initiales n₀(A) et n₀(B) des réactifs, et zéro pour les produits.
L'état intermédiaire utilise une variable x qui représente l'avancement de la réaction. Les réactifs diminuent selon leurs coefficients stœchiométriques : n₀(A) - ax et n₀(B) - bx. Les produits augmentent : cx et dx.
💡 Astuce : L'avancement maximal xₘₐₓ correspond au moment où l'un des réactifs est entièrement consommé !
Pour trouver xₘₐₓ, tu calcules n₀(A)/a et n₀(B)/b, puis tu prends la plus petite valeur. Le réactif qui donne cette valeur minimale est ton réactif limitant. À l'état final, les produits respectent toujours la proportion stœchiométrique : n(C)/c = n(D)/d.