Les bases de l'équilibre acide-base
L'eau n'est pas juste de l'eau ! Elle peut réagir avec elle-même dans une réaction d'autoprotolyse. Concrètement, deux molécules d'eau s'échangent un proton pour former les ions H₃O⁺ et HO⁻.
Cette réaction suit l'équation : 2H₂O ⇌ H₃O⁺(aq) + HO⁻(aq). Le produit ionique de l'eau Ke vaut toujours 1,0 × 10⁻¹⁴ à 25°C, ce qui donne pHe = 14.
Pour déterminer si une solution est acide, neutre ou basique, tu compares son pH à 7. Si pH < 7 → acide, pH = 7 → neutre, pH > 7 → basique.
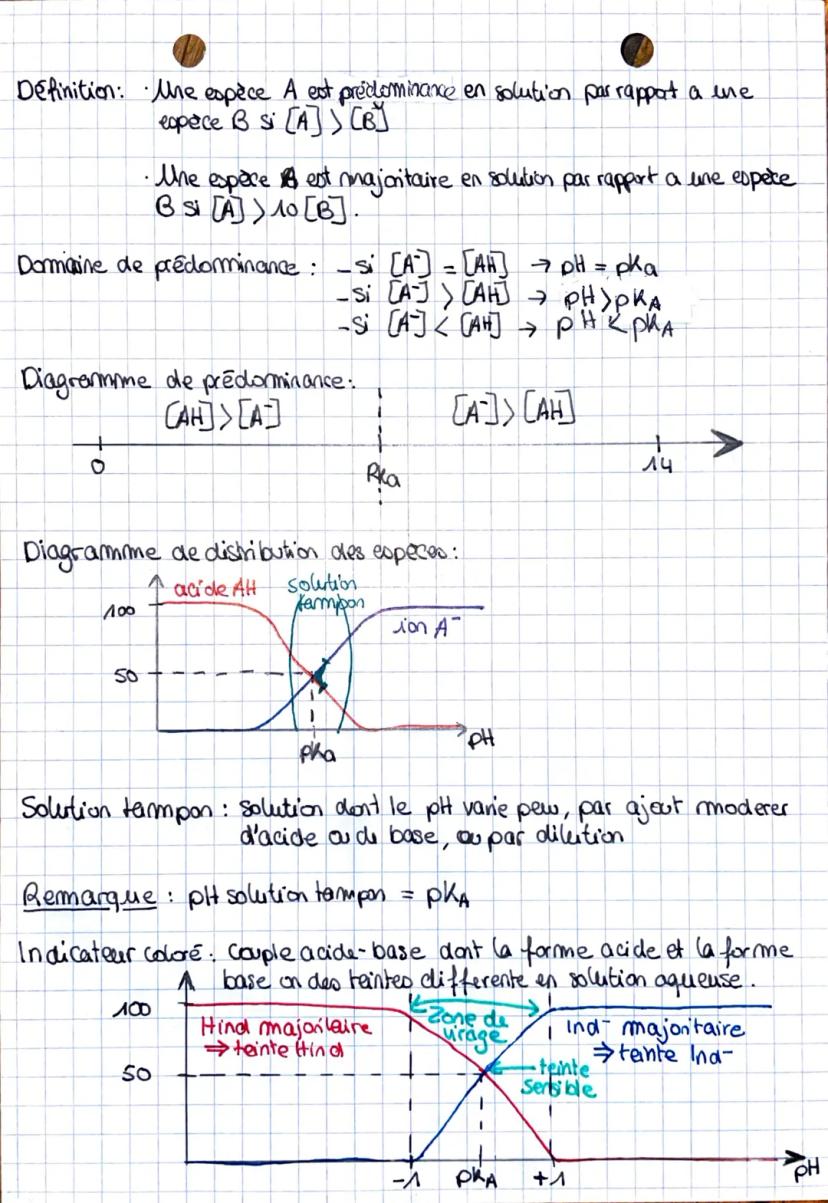
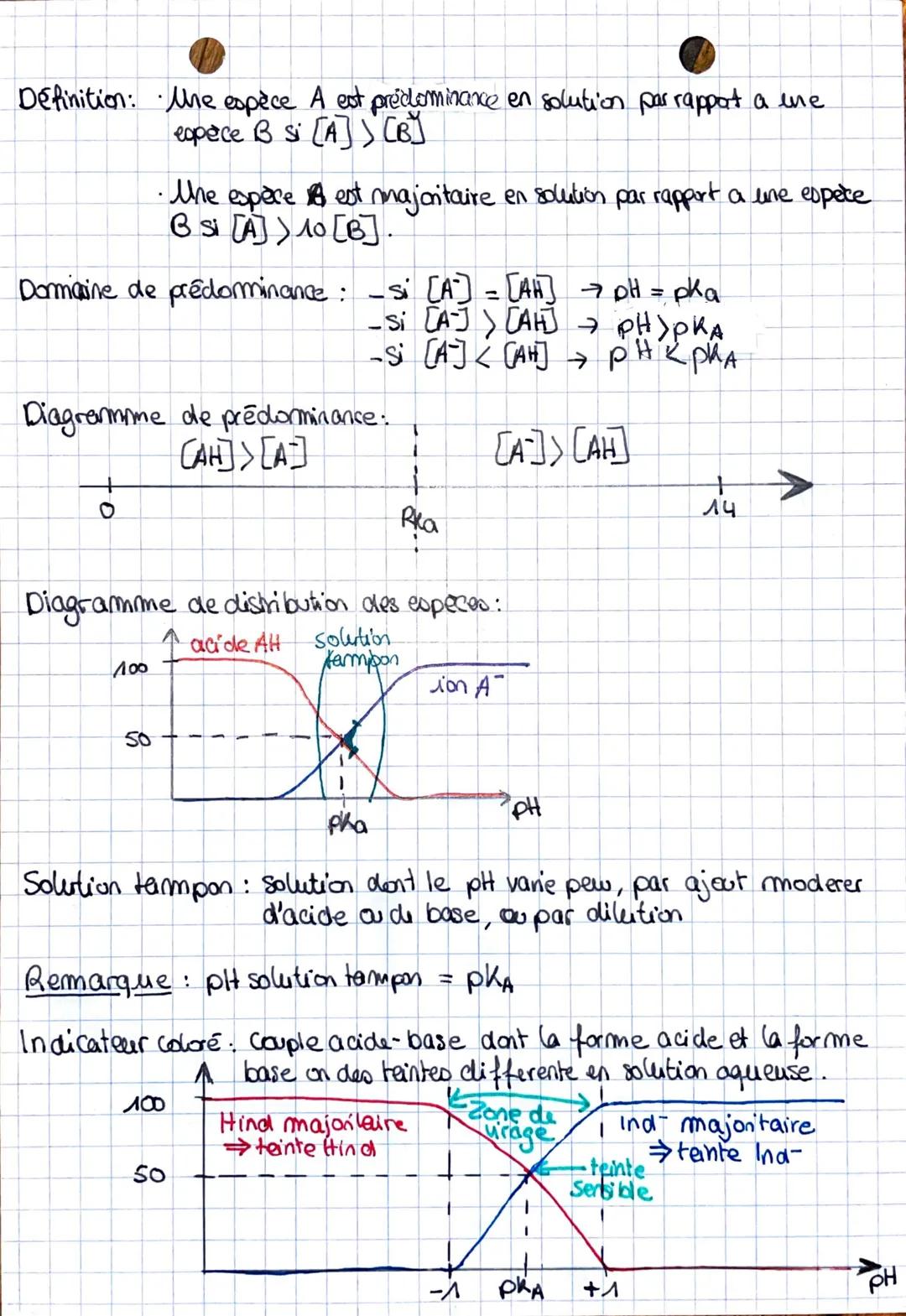
La constante d'acidité Ka mesure la force d'un acide. Plus Ka est grand (donc pKa petit), plus l'acide est fort. La relation d'Henderson pH = pKa + log[A−]/[AH] te permet de calculer le pH facilement.
💡 Astuce : Retiens que pKa et pH sont liés - quand ils sont égaux, tu as autant de forme acide que de forme basique !