Application aux piles électrochimiques
Les piles électrochimiques utilisent des réactions d'oxydoréduction pour produire de l'électricité. Un oxydant capture des électrons, un réducteur en cède - c'est un transfert indirect d'électrons entre deux couples redox.
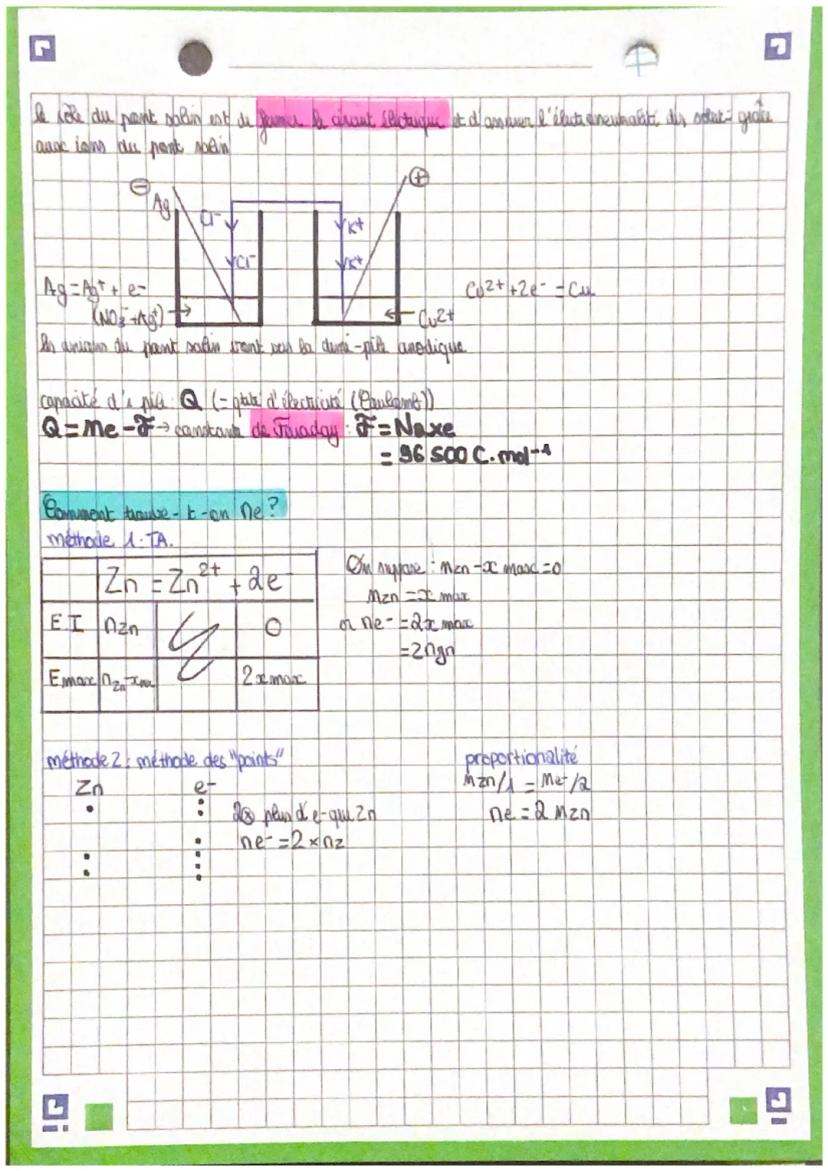
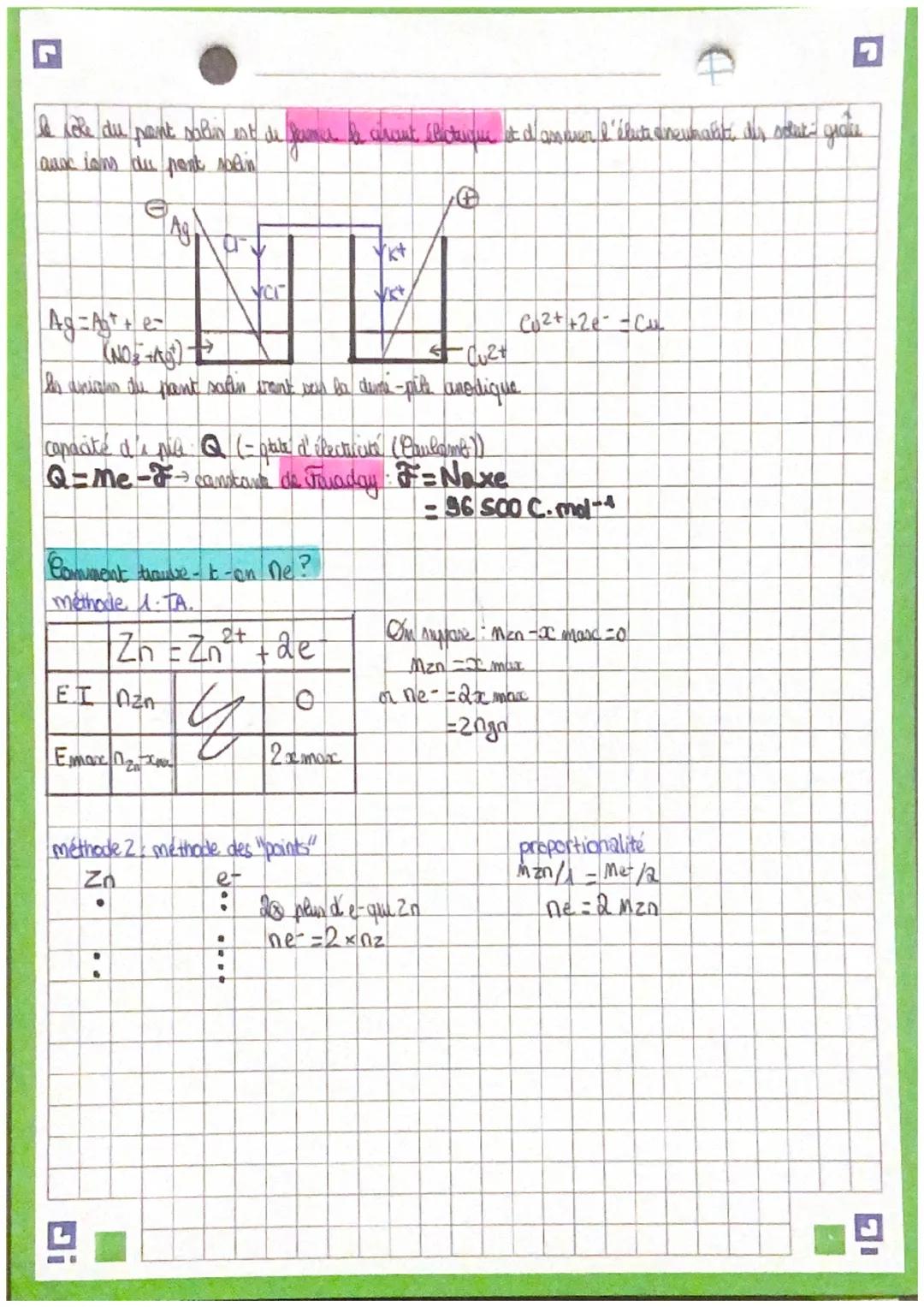
Une pile est constituée de deux demi-piles reliées par un pont salin. Chaque demi-pile contient une électrode métallique plongée dans une solution contenant l'ion correspondant. Le pont salin assure la neutralité électrique en permettant la circulation des ions.
À l'anode, l'oxydation libère des électrons. À la cathode, la réduction consomme des électrons. Le courant électrique circule de l'anode vers la cathode dans le circuit extérieur.
Pour calculer la capacité électrique Q, utilise Q = n×e⁻×F où F = 96 500 C/mol est la constante de Faraday. Le nombre d'électrons échangés (ne) se détermine facilement par un tableau d'avancement.
💡 Méthode pratique : Pour trouver ne, fais un tableau d'avancement ou utilise les proportions stœchiométriques entre l'espèce et les électrons échangés.