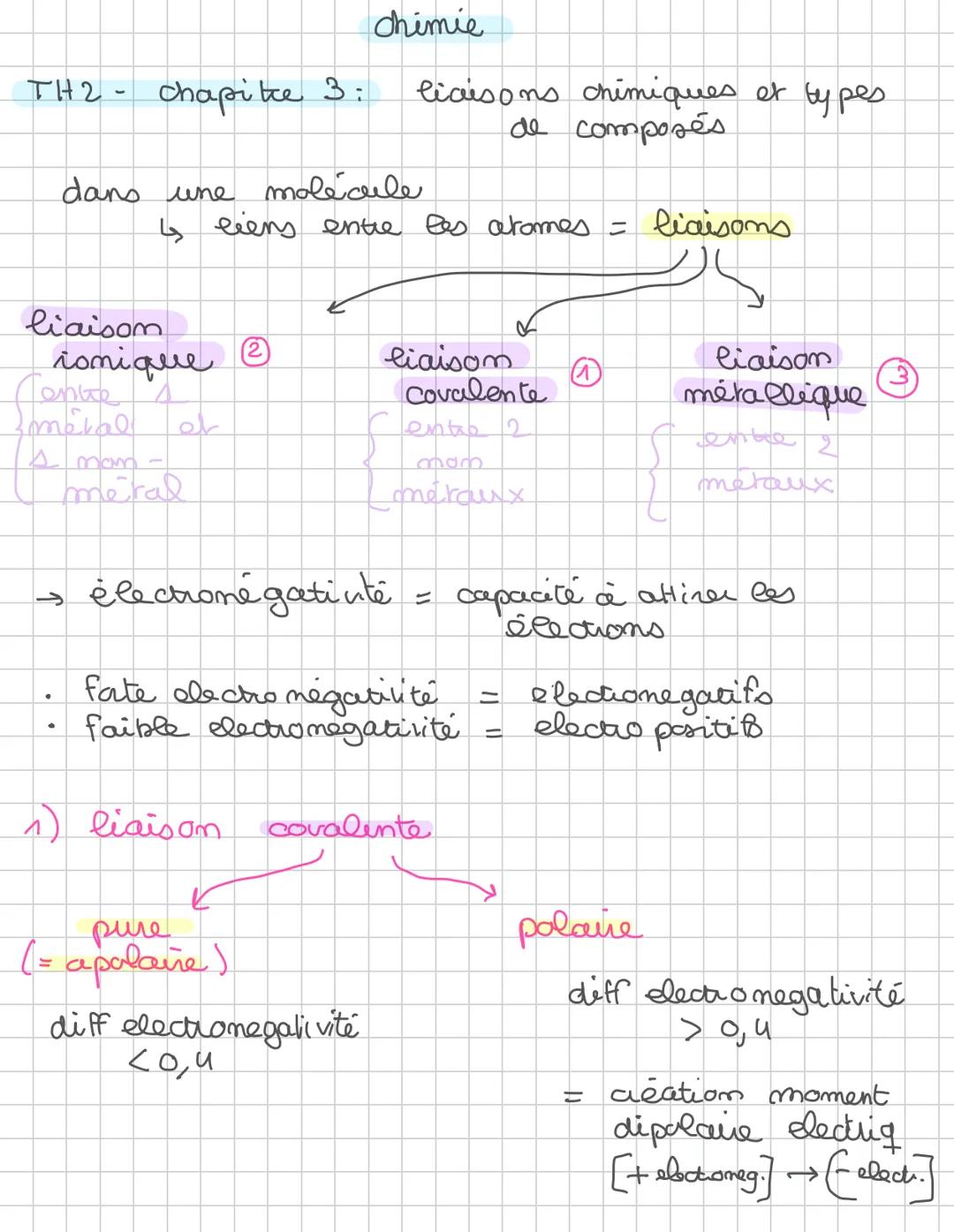
Les liaisons ioniques
Imagine des atomes qui décident de faire du troc : l'un donne ses électrons, l'autre les récupère ! C'est exactement ce qui se passe avec les liaisons ioniques. Quand un atome perd des électrons, il devient un cation (ion positif), et quand il en gagne, il devient un anion (ion négatif).
Cette transformation magique se produit entre un métal électropositif et un non-métal électronégatif. Pour qu'une liaison ionique se forme, la différence d'électronégativité doit être supérieure à 1,4. Le métal "gentil" cède ses électrons au non-métal "gourmand".
Le résultat ? Un solide ionique où les charges positives et négatives s'équilibrent parfaitement. Le composé reste électriquement neutre même si individuellement, chaque atome est devenu un ion chargé.
💡 À retenir : Dans un composé ionique comme NaCl, le sodium (Na) devient Na⁺ et le chlore (Cl) devient Cl⁻, mais l'ensemble reste neutre !