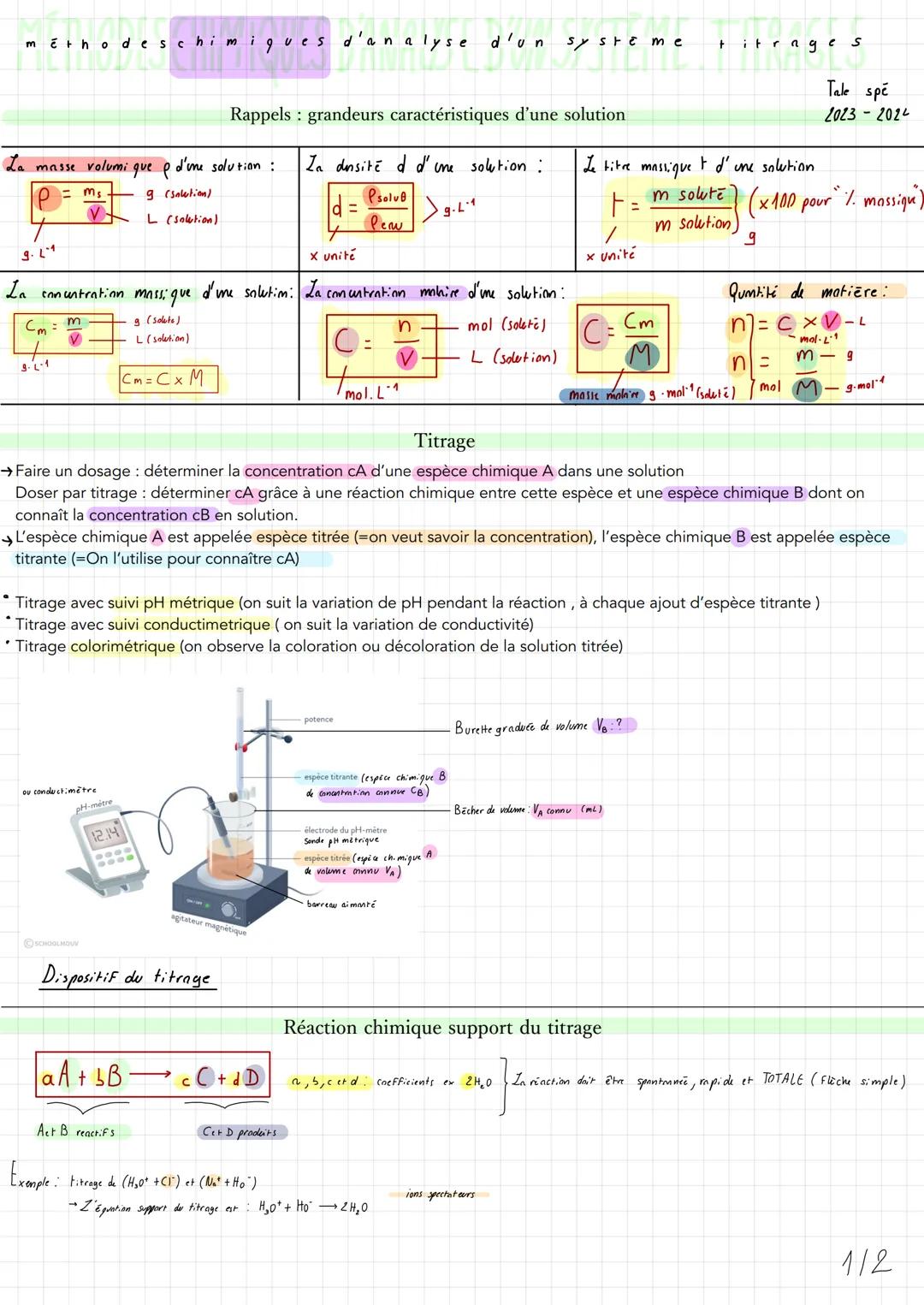
L'équivalence : le moment clé du titrage
L'équivalence, c'est LE moment crucial où tu as introduit exactement les bonnes quantités de réactifs selon leur proportion stœchiométrique. À ce point, tes réactifs A et B sont totalement consommés.
La relation fondamentale à l'équivalence est : nA/a = nB/b, ce qui te donne CA = (a × CB × VBE)/(b × VA). Cette formule te permet de calculer la concentration recherchée !
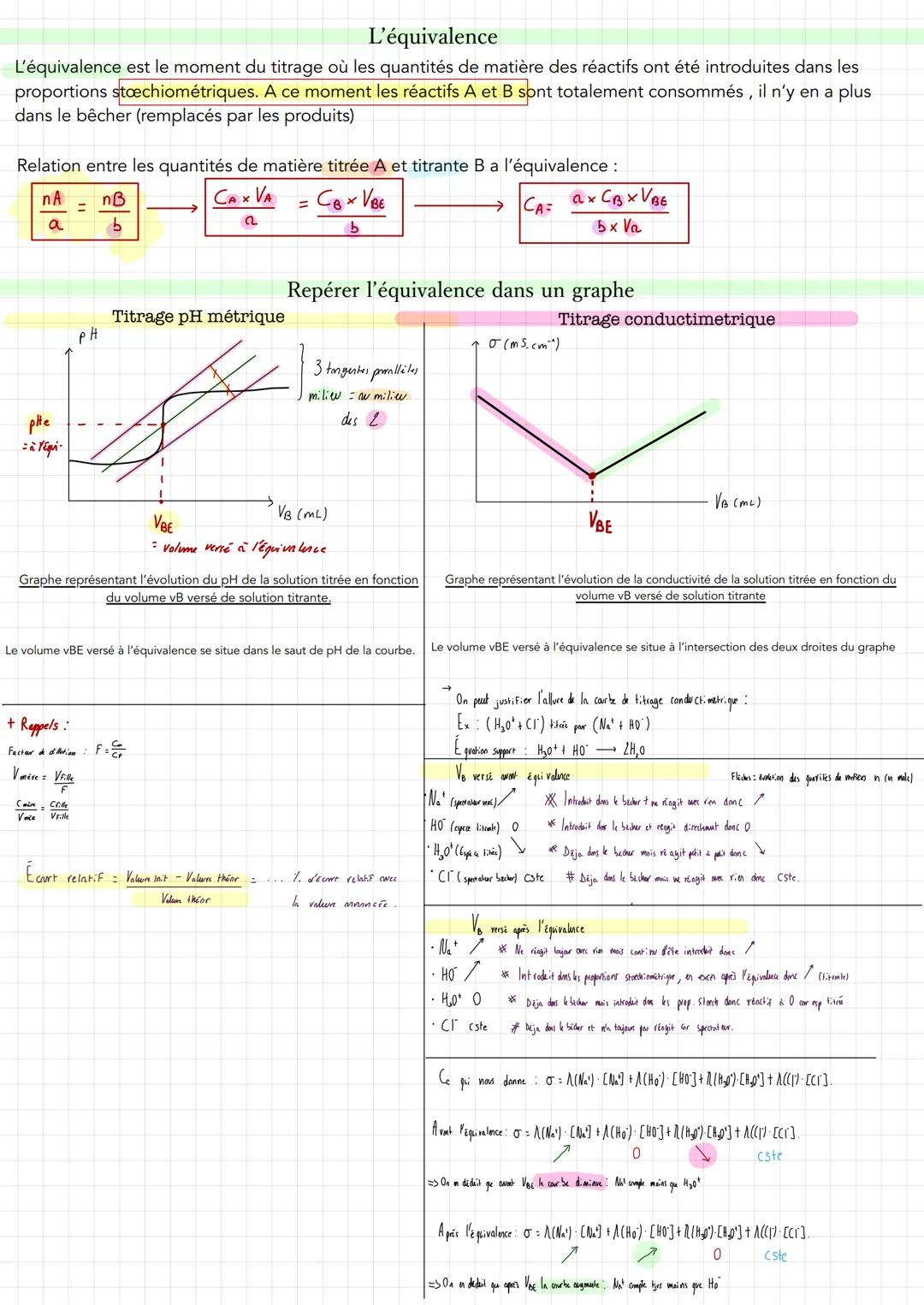
Pour repérer l'équivalence sur tes graphiques, c'est différent selon la méthode. En titrage pH-métrique, cherche le saut de pH brutal - VBE se situe au milieu de ce saut. En titrage conductimétrique, VBE correspond à l'intersection des deux droites.
Astuce pratique : Pour justifier l'allure d'une courbe conductimétrique, analyse l'évolution de chaque ion avant et après l'équivalence !
L'exemple classique HCl/NaOH montre parfaitement comment les concentrations des ions évoluent. Avant l'équivalence, H3O+ diminue progressivement. Après, HO- s'accumule en excès, d'où le changement de pente sur ta courbe.