Corrections détaillées : comprendre tes erreurs
Les corrections te montrent la méthode complète pour chaque calcul. C'est là que tu vois si tu maîtrises vraiment !
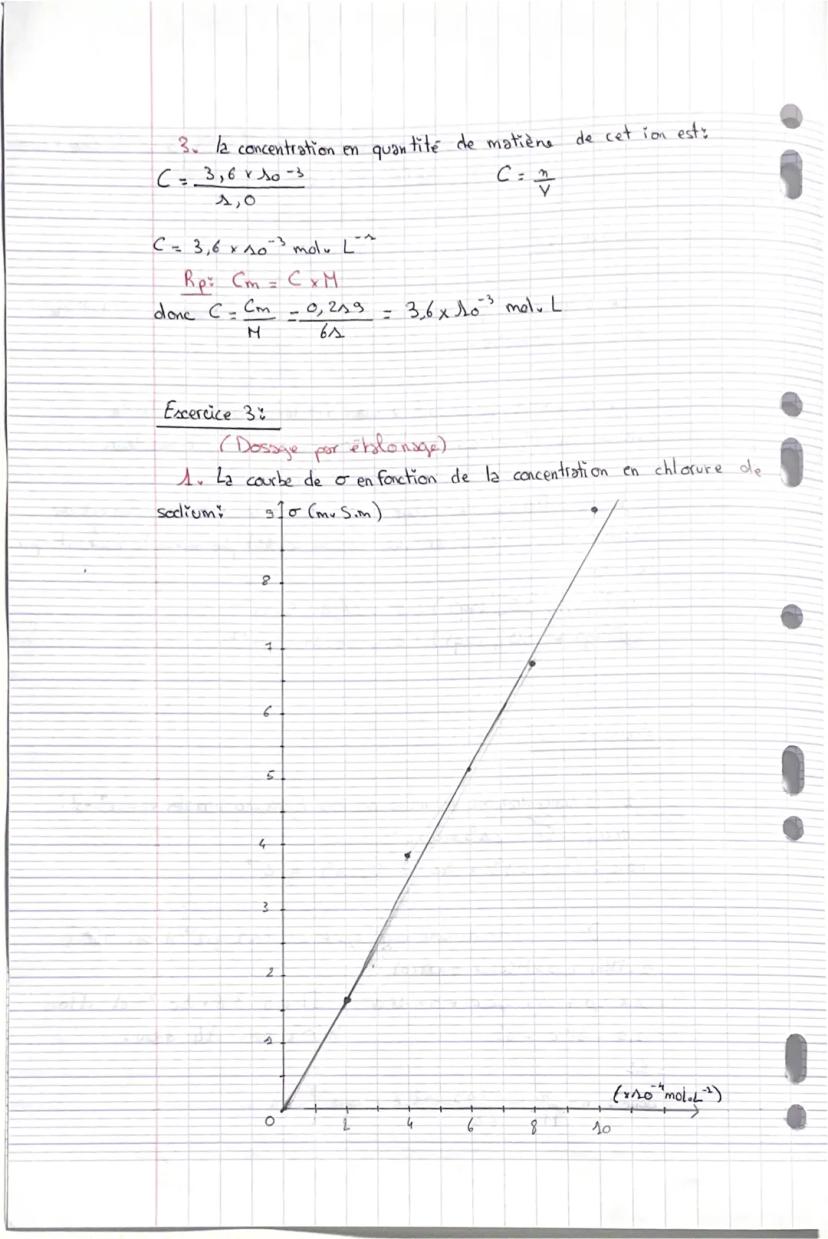
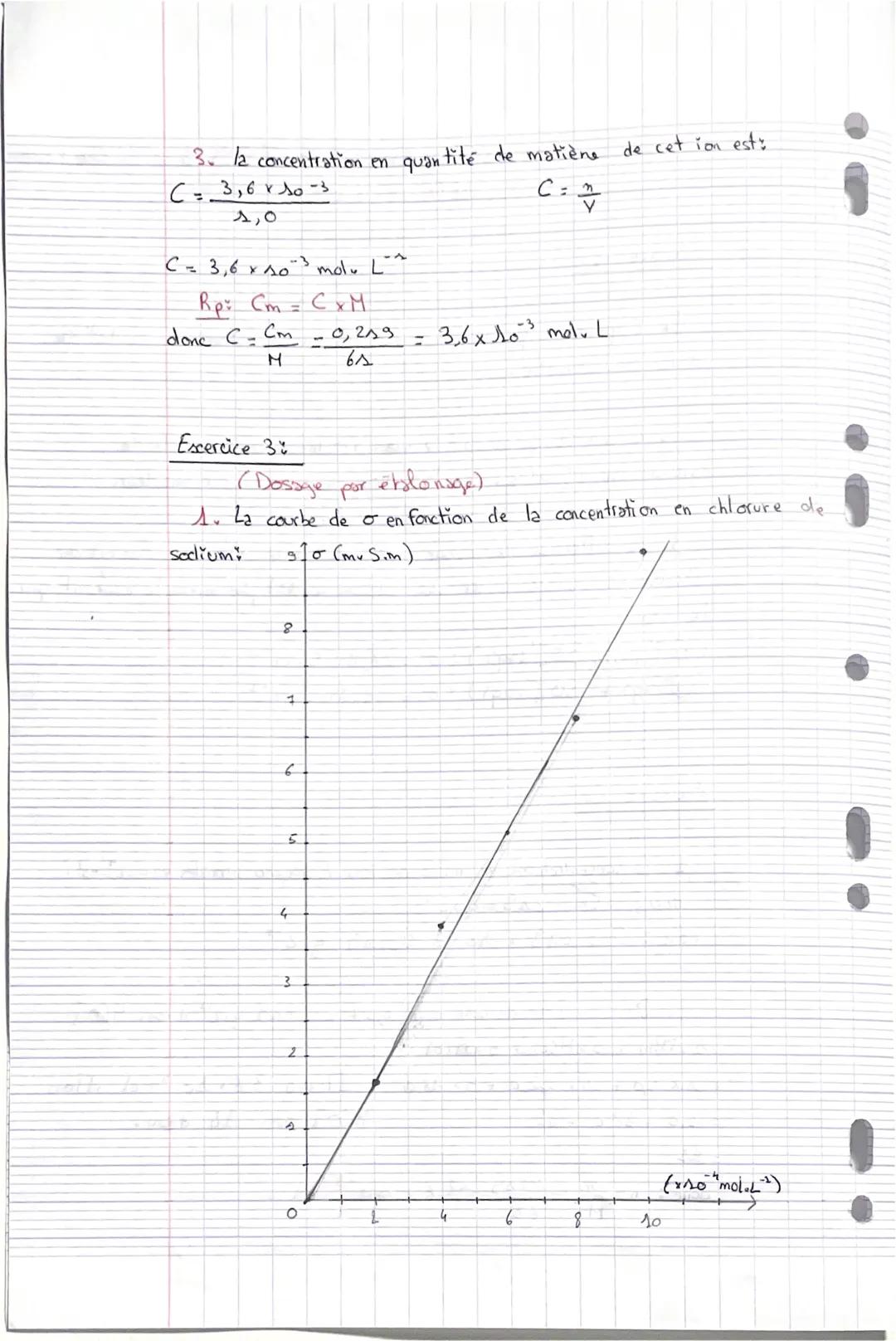
Pour l'exercice 2, la conversion des hydrogénocarbonates : 219 mg/L = 0,219 g/L. Avec M(HCO₃⁻) = 61 g/mol, tu obtiens n = 3,6×10⁻³ mol dans 1L.
La concentration molaire devient donc C = 3,6×10⁻³ mol/L. Simple quand on connaît la formule n = Cm/M !
💡 Piège classique : Attention aux unités ! Toujours vérifier mg→g et L dans les calculs.
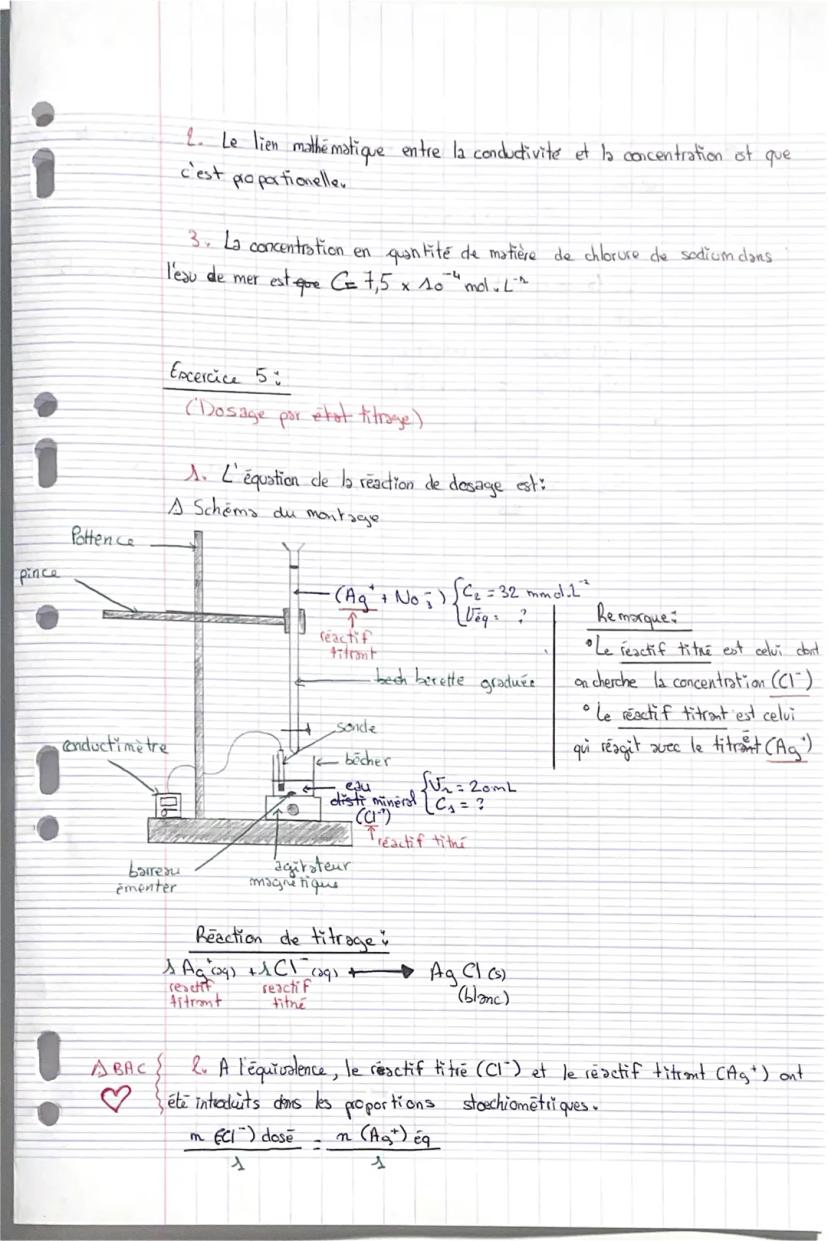
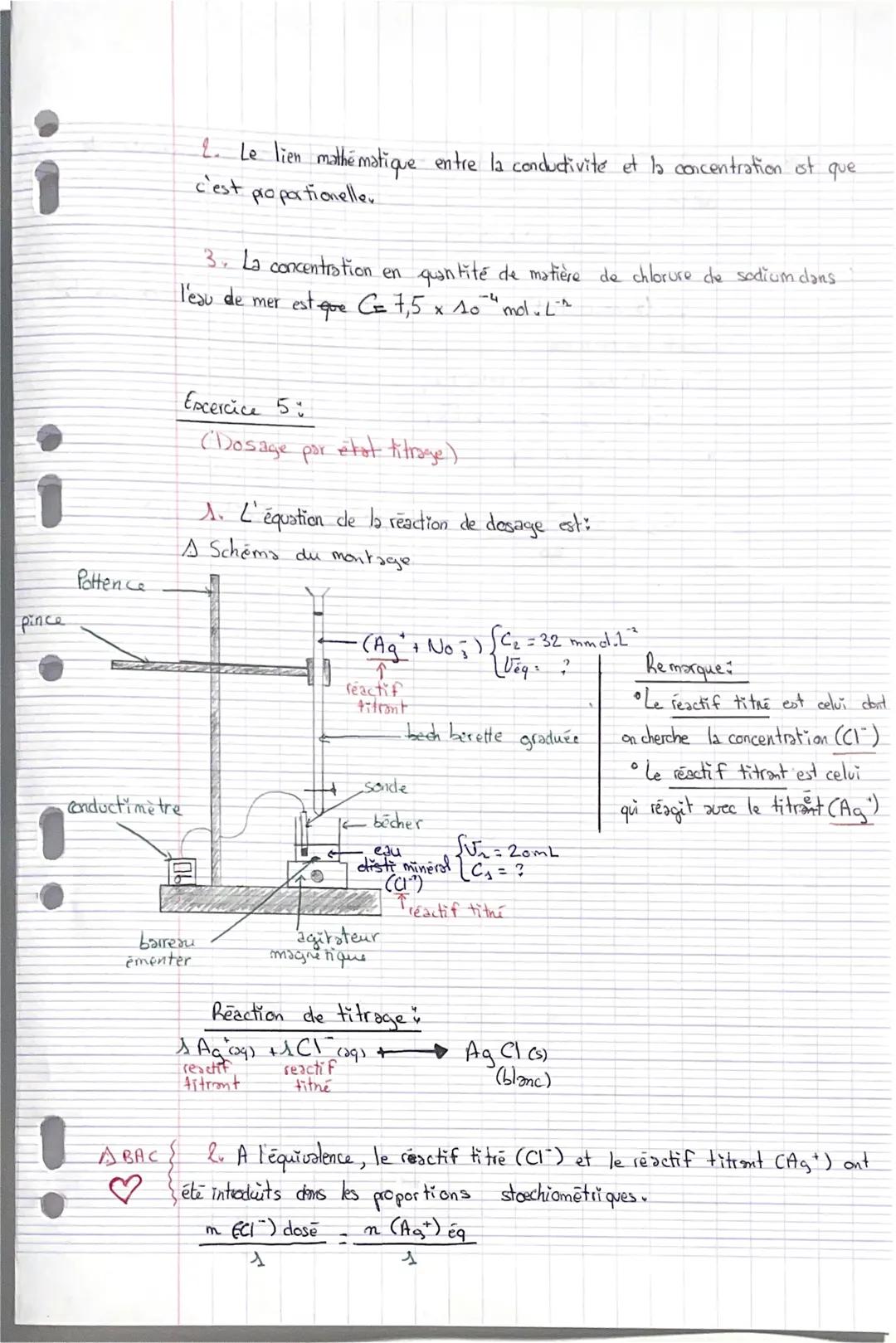
Pour l'exercice 3, la relation de proportionnalité entre conductivité et concentration est linéaire. La droite passe par l'origine, ce qui confirme que σ = k×C (avec k constante).
Ces corrections te donnent les réflexes pour éviter les erreurs types : oubli de conversion d'unités, mauvaise lecture graphique, ou erreur de formule.