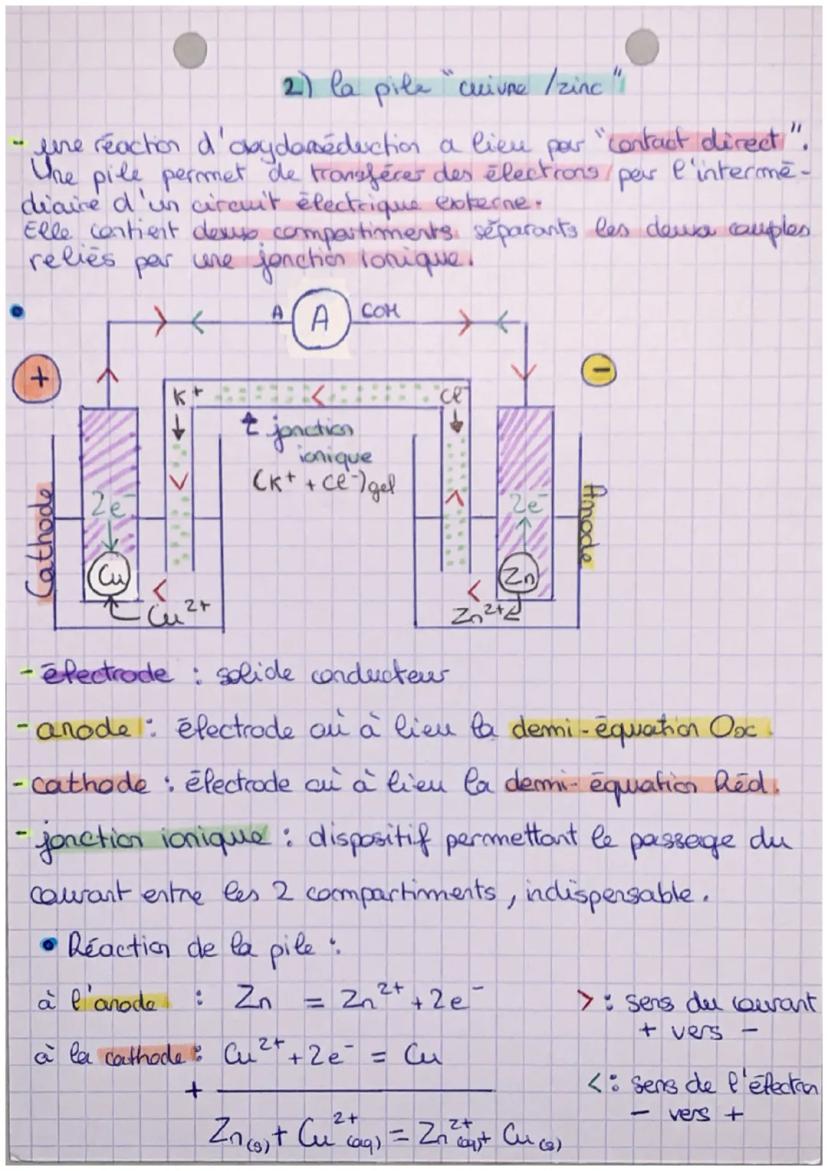
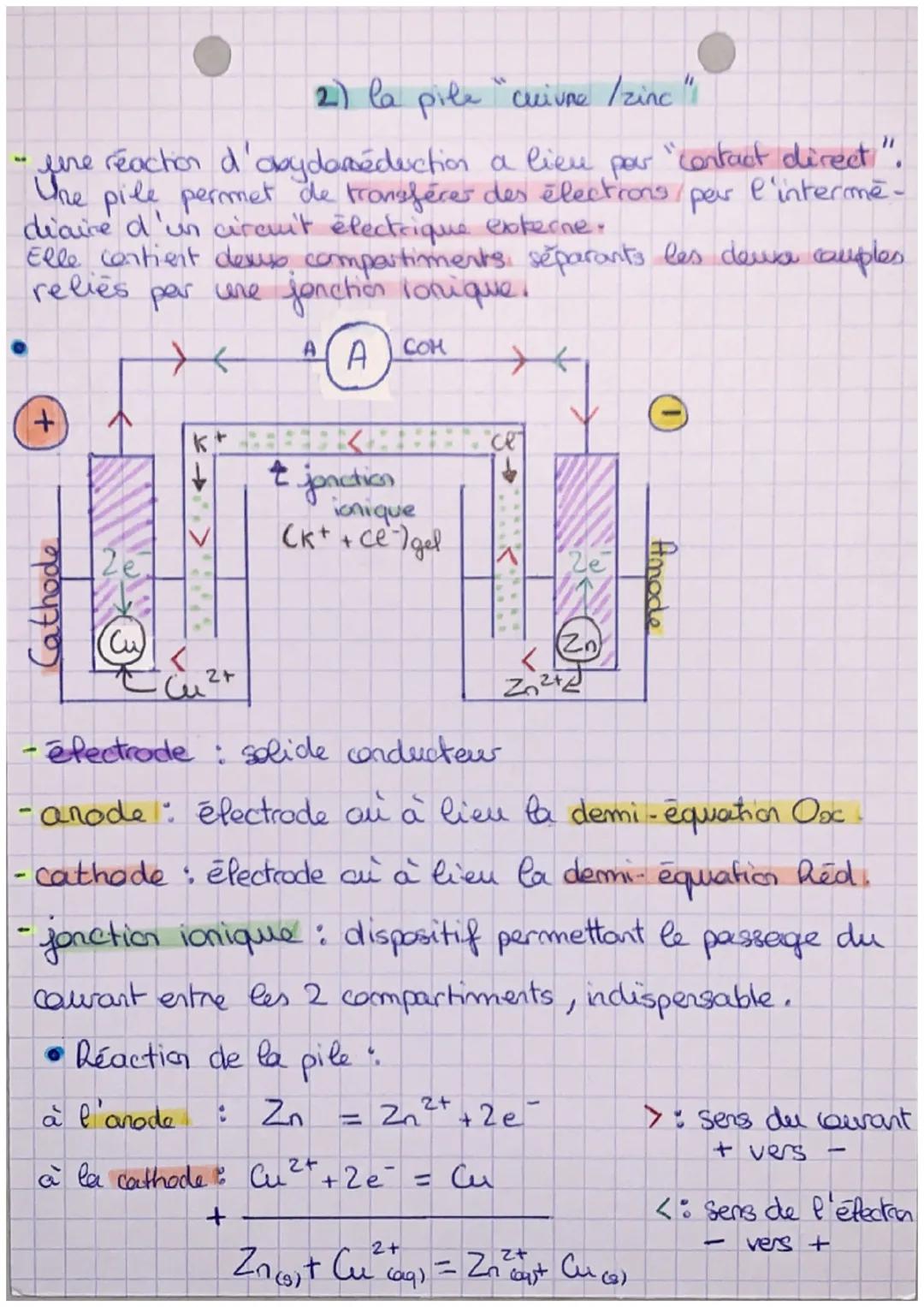
Introduction aux réactions d'oxydoréduction
Les réactions d'oxydoréduction sont partout autour de toi : dans les piles, la respiration, la rouille... Elles impliquent un transfert d'électrons entre espèces chimiques.
Un oxydant gagne des électrons (il "oxyde" l'autre espèce), tandis qu'un réducteur perd des électrons. Dans une demi-équation, tu écris : oxydant + ne⁻ = réducteur ou réducteur = oxydant + ne⁻.
Pour équilibrer, souviens-toi des règles : ajoute H₂O si tu as des atomes O en plus, ajoute H⁺ si tu as des atomes H en plus. L'oxydant se place toujours à gauche du couple, le réducteur à droite.
Les espèces amphotères comme Fe²⁺ peuvent jouer les deux rôles selon le couple considéré. Dans l'équation-bilan finale, assure-toi que le nombre d'électrons perdus égale celui des électrons gagnés !
Exemple concret : 2Au³⁺ + 3Cu → 2Au + 3Cu²⁺ (l'or oxyde le cuivre)