La force des acides et le domaine de prédominance
Tous les acides ne se valent pas ! Un acide fort comme HCl se dissocie complètement (α = 1), tandis qu'un acide faible comme l'acide acétique garde jalousement une partie de ses protons.
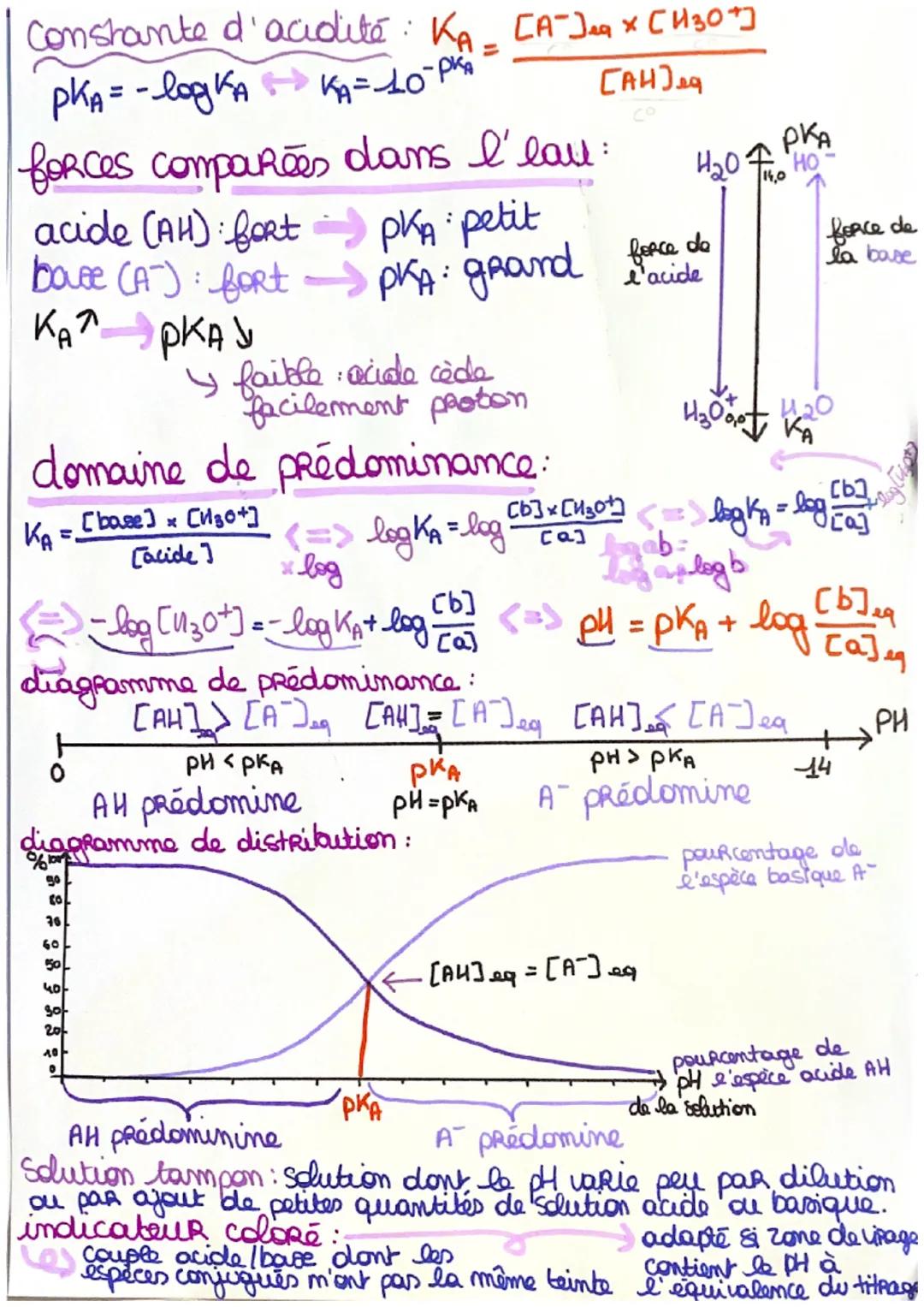
La constante d'acidité Ka te révèle la vraie personnalité d'un acide. Plus Ka est grand (donc pKa petit), plus l'acide est fort. C'est logique : un pKa petit signifie que l'acide cède facilement ses protons.
Le diagramme de prédominance te montre qui domine selon le pH. Quand pH < pKa, c'est la forme acide AH qui prédomine. Quand pH > pKa, c'est la base conjuguée A⁻ qui prend le dessus.
Les solutions tampons sont tes alliées pour stabiliser le pH. Elles résistent aux changements grâce à leur mélange équilibré d'acide faible et de base conjuguée. Ton sang utilise ce principe pour maintenir un pH stable !
🔬 Info pratique : Pour tes titrages, choisis un indicateur coloré dont la zone de virage contient le pH d'équivalence. Sinon, tu rateras le point final !